Onkologiya-
B.P.Kopnin
Rus Cancer Research Center. Blokhin RAMS, Moscova
sursa RosOncoWeb.Ru
01 0203 042. oncogenelor și Suprimarea tumorale în reglarea apoptozei
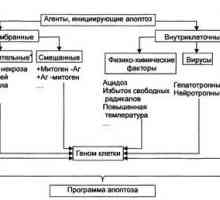
Un alt punct important de aplicare a activităților de oncogene și opuholevyhsupressorov este reglarea apoptozei (gibelikletok programată). Apoptoza este cunoscut a fi cauzate de semnale diferite :. Legarea la receptorii specifici liganzi killer nehvatkoyfaktorov de creștere / supraviețuire, deteriorarea ADN-ului și distrugerea citoscheletului, hipoxie și alte condiții nefavorabile (. Cm Recenzii [49-52]) în reglarea apoptozei sunt două etape principale : faza de inducție (de luare a deciziilor) și faza de execuție (execuție). Poslednyayaosuschestvlyaetsya prin activarea caspazei - tsisteinovyhproteinaz de familie, divizarea substraturile lor pe solduri aspartatovoykisloty. Clivajul caspazelor 3, 6 și 7 (așa-numitul "efectoare"sau "kaznyaschie" Caspase) un număr de substraturi cheie vchastnosti DFF45 / ICAD - inhibitor nucleazei DFF40 / CAD (osuschestvlyaetsyakaspazoy 3), lamins - proteine citoscheletale nucleare (osuschestvlyaetsyakaspazoy 6), etc., conduce la fragmentarea ADN-ului și degradarea celulei [52]. Caspazele prezente în citoplasmă ca aktiviruyutsyado proenzimov și proteazele complet funcționale prin clivaj proenzimana subunități mari și mici și clivaj în continuare din domeniile nihN-terminale. Apoi subunitățile asambla într-un tetramer sdvumya centre active ale [49,52]. procaspases Divizarea mogutosuschestvlyat diverse proteaze, inclusiv alte caspaze.
Se presupune că există cel puțin două căi de semnalizare printsipialnoraznyh care duc la activarea caspazei 3, 6, 7, [49,52] (Fig. 5). Un spetsificheskihkillernyh inițiat de legarea moleculelor (Fas-ligand, TNFa și altele.) La receptorii lor, cauzând recrutarea de proteine adaptor și procaspases în chastnostiprokaspazy 8. Agregarea procaspase 8 molecule suficiente chtobyinitsiirovat autoprotsessirovanie lor (divizare) și caspaza 8 forme obrazovanieaktivnyh care, la rândul lor, agenții Cele"kaznyaschie" caspaze. Într-un mecanism alternativ rasschepleniekaspaz 3, 6, 7 caspazei efectuat 9, în care activarea mitocondrial initsiiruetsyavyhodom proteaza FIA (Apoptoza factorul de inducere) și / sau de citocrom c procaspases legare stimulatorii 9 belkomApaf1 (omolog CED-4 proteine in C. elegans), și în consecință, obrazovanieagregatov procaspases și 9 la autoprotsessirovanie lor activă form.Pronitsaemost membranei mitocondriale la FIA și citocromul sreguliruetsya familiei de proteine BCL2. Această familie de proteine include strukturnoskhodnyh mai mult de doi membri duzini, chisleprodukty BCL2 proto-oncogenelor și bcl-x, având apoptoza sposobnostyublokirovat si supresoare tumorale Bax, invers, indutsiruyuschiyapoptoz [53-55]. Se presupune că antiapoptogennye molekulyBcl2 și Bcl-x, localizate în membranele mitocondriale, canale, prin care eliberarea citocromului c și / sau FIA închise. Bax, situat în mod normal în citoplasmă anumitor compartimente, sa mutat in Semnale priapoptogennyh cu membrana mitocondrială unde interacționează cu mitohondrialnoymembrany exterior proteic integral VDAC, stimulează deschiderea canalului prin care un sekretiruetsyatsitohrom. Mai mult, Bax formează un complex heteromeric de belkamiBcl2, Bcl-x, care poate fi închisă pentru a deschide acest canal [54,55]. Alte familie Bcl2 pro-apoptotice de proteine (Bak, Bad, Bid, etc.) par să aibă efecte similare [53,55].

Fig. 5. Participarea oncogene și supresoare tumorale în regulyatsiiapoptoza (explicații în text)
Dacă Bcl2, Bel- și Bax eliberare controlată direct molecule izmitohondry apoptogenic, apoi mai multe alte protoonkogenovi supresoare tumorale regleaza activitatea acestora si a altor belkovsemeystva Bcl2 (Fig. 5). Una dintre cele mai puternice astfel regulyatorovyavlyaetsya supresoare tumorale p53. Fiind activat ca raspuns la samyeraznye efecte adverse (deteriorarea ADN-ului, hipoxie, pierderea contactului celulei cu substratul, semnalul mitogenă nereguliruemayastimulyatsiya permanent și multe altele [13,14,56-58], p53 duce la nivelul transcripției și aktivatsiyugena simultan bax, și reprimarea BCL2 genei [57,59]. In plus, unele PIG gene p53 povyshaetekspressiyu, ale căror produse cauzează oksidativnyystress și ca o consecință, tulburări de permeabilitate mitohondrialnoyi membrană nucleară [60] și, de asemenea, anumite transactivează killernyeretseptory În particular Fas și KILLER / DR5 [57,61,62]. Astfel, activarea apoptotice p53 dă un semnal puternic în implementarea diverselor mecanisme de inducție kotorogozadeystvovany "kaznyaschih"caspaze. Este important de subliniat faptul că dependente de p53 organismului apoptoza eliminiruetiz nu numai celulele deteriorate, dar, de asemenea, celule în kotoryhnablyudaetsya stimularea neregulată a proliferării celulare cauzate de, de exemplu, activarea constitutivă a oncogena myc și / sau transkriptsionnogofaktora E2F. Stabilizarea p53 cu activarea oncogenelor svyazanas indus creșterea E2F transcriere p19ARF produktkotorogo genei previne degradarea Mdm2 dependentă de p53 [13,14]. Firește, mutațiile de inactivare a p53 si p19ARF, mecanismul etogozaschitnogo perturbator va creste in mod dramatic probabilitatea poyavleniyapostoyanno proliferante clone de celule și, prin urmare, iveroyatnost dezvoltarea ulterioară a acestor tumori.
Interesant, expresia constitutivă a oncogene Ras initsiiruetodnovremenno și semnalele apoptotice și antiapoptogennye. activarea Pervyeobuslovleny a căii de semnalizare Ras-Raf-MAPK-E2F-p19ARF-p53 [63]. Acestea din urmă sunt conectate atât la capacitatea unuia dintre effektorovRas - proteina Raf - fosforilează direct și inactivează proapoptoticheskiybelok Bad (membru al familiei Bcl2) și cu acțiunea unui alt effektoraRas - PI3K (fosfoinozitol-3-kinazei) [21,51,63,64]. PI3K Antiapoptoticheskieeffekty datorită capacității sale de a activa serin treoninovuyuproteinkinazu PKB / Akt (primul a fost identificat ca onkogenretrovirusa AKT8, cauzand limfom cu celule T la șoareci AKR), care blochează apoptoza în mai multe moduri [65] (vezi. Fig. 5) .Vo În primul rând, este ca Raf, are capacitatea de a inactiva proteina fosforilirovati Bad. Mai mult, funcția de suprimare a belkaDAF-16 - Forkhead familie factor de transcriere - PKB / Aktmozhet inhiba producerea de molecule killer, in special Fas-liganda.I în cele din urmă a descoperit recent că PKB / Akt funktsiyutranskriptsionnyh activeaza Factori Rel / NF-kB familie [65 ] (Omologii virusnogoonkobelka amplificare v rel- și reglarea genelor lor harakternydlya multe tumori umane [66]), care, la rândul lor, inhibă apoptoza în mai multe moduri (vezi Fig. 5). In particular, gena care codifică o proteină ontransaktiviruet A1 / Bfl1 - semeystvabelkov membru Bcl2, inhibă eliberarea citocromului C și / sau FIA [67]. Naryadus acestea, expresia NF-kB crește inhibitori ai apoptozei IAP1i IAP2, membri ai familiei de proteine IAP (Inhibitorii Apoptoza), funcția de blocare a caspazelor 3, 6, 7, 8, 9, [66]. În legătură cu izlozhennymstanovitsya clar una dintre funcțiile protectoare ale tumorii supressoraPTEN (inactivarea sa natural găsit în glioame, rakahmolochnoy si de prostata si mutatii congenitale duc la razvitiyusindroma hamartom multiplu [68] Tabelul 2.) Protein PTEN, obladayuschiyaktivnostyami fosfataza tirozina, inhibă antiapoptogennyeeffekty PI3K-PKB semnal / Akt [69].
Pentru celulele neoplazice caracterizate prin disfuncție și supresor drugihopuholevyh exercitarea upregulation apoptoza.Tak, dezvoltarea leucemiei mieloide cronice obuslovlivaetsyahromosomnoy translocația t (9-22), care a avut ca rezultat obrazuetsyahimerny genei BCR / ABL. O astfel de restructurare cauzează consecințe odnovremennodva importante: cai a) o creștere dramatică a tirozin kinazei aktivnostibelka Abl, ceea ce duce la stimularea mitogenică și antiapoptoticheskogosignalov mediată de Ras reglementate de semnalizare [70,71], precum și sinteza crescută a integrinelor care furnizează luchsheeprikreplenie la matricea extracelulară [72] și b) inactivarea apoptogennyhaktivnostey Abl [73-75], ca urmare, se pare că, ea uchastiemv upregulated JNK (de asemenea, numit SAPK, stres ActivatedProtein Kinase), care are o capacitate de a suprima și ktivnostBcl2 și poate activa p53 (Fig. 5). Mai multe date ukazyvayuttakzhe că proteina Abl se poate lega direct sr53, modificarea funcției sale proapoptotic [57,65,75].
Rezultatul cromozomale translocare t (15-17), nablyudayuscheysyav marea majoritate a cazurilor de leucemie acută promielocitică, este un compus al genei receptorului de acid retinoic (RAR-a) PML gena supresoare c tumorale [3,12,76], produsul kotorogoobrazuet in nucleul specific matrice asociată teltsa.Predpolagaetsya că proteina de fuziune LMP / RAR-un inactivează de o negativnomumehanizmu funcție apoptotic dominantă de proteină normală LMP, l obrazuyas heterodimeri. Mecanismele de inducere a apoptozei la giperekspressiiPML nu a fost încă pe deplin clar. Datele despre participarea la aktivatsiikaspaz 1, 3 și recrutarea proteinei Bax în timpul apoptozei, indutsirovannomTNF-a, interferon 1 și 2, activarea Fas și deteriorarea ADN-ului [77,78]. În plus față de reglarea apoptozei LMP controlează, de asemenea, de reproducere, probabil, diferențierea celulelor progenitoare mieloide. Astfel, se arată că transactivarea p21WAF1 / CIP1, este responsabil pentru ciclul ostanovkukletochnogo sub efectul acidului retinoic oposreduetsyaimenno LMP [79]. Astfel, exprimarea proteinei de fuziune LMP / RAR-o, cauzând inactivarea funcției normale a proteinei PML, ca perestroykaBCR / ABL, conduce simultan la modificări ale kletochnogotsikla reglarea și blocarea parțial inducerea apoptozei (sleduetzametit care, spre deosebire de BCR / rearanjare ABL LMP / RAR-un bloc și vyzyvaettakzhe differentsirovki- cm. secțiunea 8). Ca rezultat al moleculelor de fuziune de acțiune mnogonapravlennogoharaktera apar celule povyshennymproliferativnym potential si la rezistenta la semnalele negativnymregulyatornym și / sau a condițiilor nefavorabile ambientale același timp. Se presupune că astfel de modificări pot fi deja dostatochnymidlya dezvoltarea de cel puțin unele forme de leucemie. Intr-adevar, restructurarea BCR / ABL sau PML / RAR-o yavlyayutsyaedinstvennymi frecvente modificari genetice detectabile mieloide cronice sootvetstvennopri și leucemia acută promielocitică [3,12].
Cu toate acestea, pentru dezvoltarea formelor maligne ale tumorilor solide (cancere, sarcoame, etc.) Desigur, aceasta necesită alte modificări în interacțiunile celulare încălcare condiționate pervuyuochered cu svoimisosedyami și matricei extracelulare, în special pierderea imizavisimosti de substrat și de contact inhibarea reproducerii îmbunătățite activitatea locomotorie responsabile pentru celulele de invazie tisulară și capacitatea altora-vokruzhayuschie stimulirovatprorastanie neoplazice vasculare (neoangiogeneză) în țesutul tumoral pentru alimentarea obespecheniyaee etc. În acest sens, nu este surprinzător faptul că numărul de tumori detectabile kletkahsolidnyh mutații și alte geneticheskihizmeneny obicei semnificativ mai mare decât în celulele leykozov.Chislo rearanjamente genetice adesea ajunge la neskolkihdesyatkov în acesta. Este clar că, pe baza ratei obișnuite de mutație, celulele normale harakternogodlya, nu poate explica apariția un număr kletketakogo de tulburări genetice. Deci, înainte de chempereyti la analiza rolului proto-oncogene și reglementarea celulelor tumorale supressorovv reacțiilor morfogenetice și neoangiogenesis, ia în considerare mecanismele de nestabilnosti- genetice O altă caracteristică importantă a celulelor neoplazice.
3. proto-oncogene și Suprimarea tumorale în geneticheskoystabilnosti de controlObservată în celulele neoplazice induc supresia apoptozapovyshaet viabilitatea celulelor care suferă povrezhdayuschimvozdeystviyam ADN-ului, și astfel, în sine crește veroyatnostsohraneniya orice tulburări genetice. Cu toate acestea, în celula suschestvuyuti alte funcționarea necorespunzătoare a sistemului de control al tselostnostigenoma, mai specializat, care este, de asemenea, caracteristică opuholevyhkletok.
Genomul integritatea sistemului de monitorizare pot fi împărțite în două grupe: 1) sisteme de reparație care detectează și ispravlyayuschieoshibki care conduc la modificări ale ADN-ului a secvenței nukleotidovv, și 2) sistemul de control proliferarea ciclului celular predotvraschayuschiedalneyshee celulelor care au apărut deja sau perturbare mogutproizoyti a structurii sau a numărului de cromozomi .
Sistemele de reparații Modificările sunt caracterizate, aparent pentru otnositelnonebolshoy tumorilor. Cu toate acestea, ele pot juca un rol fundamental în dezvoltarea tumorilor nekotoryhform. Astfel, genele vrozhdennyedefekty ale căror produse sunt responsabile pentru excizie reparatsiyuDNK cauza xeroderma pigmentosum - Sindrom harakterizuyuschiysyarazvitiem multiple tumori ale pielii, în locuri podvergayuschihsyasolnechnomu iradiere [80]. Interesant, cu toate că repararea uchastieekstsizionnoy corectarea defectelor provocate de iradiere nu tolkoUF, ci, de asemenea, o varietate de mutageni / cancerigeni [81,82], frecvența apariției altor forme de tumori kserodermepochti pigment nu este crescut. Astfel, șoarecii transgenici analogichnymidefektami sistem repararea excizia este marcat tumori povysheniechastoty inductoare cu agenți cancerigeni chimici vnutrennihorganov [82]. ocurență preferentiala la pacienții cu tumori de piele pigmentnoykserodermoy pot indica factorii rolhimicheskih minori poluantă razvitiinovoobrazovany la om [83].
defecte congenitale alt sistem de reparații, replicare a ADN ispravlyayuscheyoshibki, conducând la formarea nesparennyhosnovany ("nepotrivire de reparații") Cauza caracteristica Lincha.Glavnoy a acestui sindrom este dezvoltarea tumorilor sindromului tolstogokishechnika (așa-numita "kolorektalnyyrak nonpolipozic ereditar") Și / sau cancer ovarian [83-86]. (Tumori intestinale vozniknovenieimenno preferentiale cu defecte ale sistemului de reparare poate fi asociată cu cea mai mare proliferativa jos potențial kletokna criptelor intestinale, ceea ce conduce în mod natural la mai multe erori de replicare chastomupoyavleniyu.) A identificat patru gene - MSH2, MLH1, PMS1 și PMS2, mutații de inactivare care conduc ketomu de [84-86]. Marker inactiva oricare dintre aceste genovyavlyaetsya ușor detectabil microsatelit instabilitate posledovatelnosteyDNK [83,87]. Încălcările de reparare a sistemului osnovaniyharakterny nepereche și pentru unele forme de (non-ereditare), tumori sporadice: acestea se găsesc în 13-15% din tumorile de colon, cancer gastric si endometrial, dar mult mai puțin frecvent (<2%) в другихновообразованиях [83].
Se presupune că tulburările în sistemul repararea ADN-ului dvunitevyhrazryvov efectuat prin recombinare omologă, poate conduce la dezvoltarea anumitor forme de tumori. Pare a fi chiar indica faptul ca proteinele supresoare BRCA1 si BRCA2, mutatii germinale care sunt responsabile de san ereditare formyraka si cancerul ovarian [85,86,88], au complex sposobnostyuobrazovyvat cu RAD51 proteine - Omologul bakterialnogobelka RecA, responsabil pentru recombinare omoloagă și inactivarea ("knock-out") Genele BRCA1 și BRCA2 duce la o povysheniyuchuvstvitelnosti ascuțită la g iradiere [89-91]. Cu toate acestea, în timp ce okonchatelnoneyasno, indiferent dacă sunt sau nu în încălcarea carcinogenezei funcției BRCA1i BRCA2 cauzate de acestea, și nu o alta din aktivnostyami.V lor particulare, trebuie remarcat faptul că repararea razryvovDNK dublu-strand are loc în anumite perioade ale ciclului celular, ostanovkav care crește dramatic eficiența procesului. Este posibil ca abilitatea proteinei BRCA1 pentru a crește expresia mecanismelor p21WAF1 / CIP1 cherezr53-dependente și-p53 independent [30,31], și invers, capacitatea de a inhiba proteina myc transactivare [92] napravlenaimenno privind oprirea ciclului celular în celulele lezate.
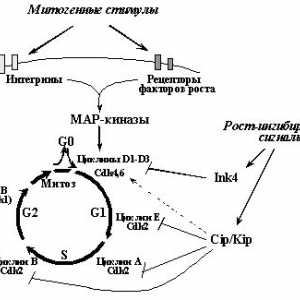
În cazul în care o încălcare a sistemelor de reparații și conexe "nukleotidnayanestabilnost" implicate în dezvoltarea anumitor forme de tumori relativ nebolshogochisla, atunci "instabilitatea cromozomiale"Reieșind din încălcări ale regulamentului normal al ciclului celular, este caracteristic, aparent, pentru solidnyhopuholey marea majoritate. Ciclul celular este postulat existența așa-numitul"puncte de control" (Checkpoints), trecând kotoryhvozmozhno numai în cazul în care valoarea normală a etapovi anterioare nici un prejudiciu. Emit cel puțin patru astfel de puncte: în G1, S, G2 și "Ansamblu de încercare ax punctul"în mitoză [27,93-95].
Punct de control în G1. Cerința principală pentru celula vstupayuscheyv fazei S - pentru a ADN-ului este intactă, deoarece replicarea deteriorate DNKprivedet pentru a transfera anomalii genetice descendenți. Prin urmare, celulele expuse influențelor mutagene care cauzează ruperea catenei de DNA (UV și g iradiere și alți agenți de alchilare.) Ostanavlivayutsyav G1 și introduceți faza S [95,96]. O oprire în nablyudaetsyane G1 numai după ce efecte daunatoare ADN-ului, dar, de asemenea, cu drugihsostoyaniyah, inclusiv duce la încălcări ale cromozomiale în timp ce mitozei anterior ciclului celular (raskhozhdeniemhromosom) [97], în cazul în care nu vremyamitoza în segregarea cromozomilor, ceea ce duce la formarea de micronuclee [ 98], și, de asemenea, la razrusheniimikrotrubochek care poate determina ulterior mitoză nedorită [99]. O oprire în G1 poate fi ireversibil, după caz nablyudaetsyav g-iradiere [100] sau reversibil, stins cu okonchaniemdeystviya factor, sa declanșat, de exemplu, atunci când rezerva de nucleotide vosstanovleniinormalnogo [56101] sau sistemymikrotrubochek restaurare [98].
Punct de control în faza S monitorizează replikatsiiDNK corectă. În special, o oprire la o anumită perioadă de nablyudaetsyapri faza S lipsesc nucleotide în celule, nu sa oprit din orice motive silukakih G1 [102].
Punct de control în G2. deteriorarea ADN-ului și a altor tulburări vyzyvayutostanovku celule nu numai în G1- și S-, dar în kletochnogotsikla G2-fază. Astfel detectate leziuni pierdute la punctele prohozhdeniipredyduschih sau primite la ciclul stadiyahkletochnogo ulterioare. Mai mult, în G2-fază este detectat ADN polnotareplikatsii și celule în care ADN-ul nu nedoreplitsirovana vhodyatv mitozei [103].
Sverochnaya punctul de asamblare a axului (punct de control ax-montaj) .Vo celulelor evita alocarea necorespunzătoare metafază cromozomiale zaderzhivayutsyav până când toate kinetochores sunt microtubuli prikreplenyk. Distrugerea kinetochores neatașate lazernympuchkom inițiază debut anafaza [104], în timpul căreia cromozomii nu proiskhodyatotstavanie atașat la axul de divizare și să le obrazovanieiz micronucleu. Determinarea rol în inducerea metafazeigrayut opri schimbarea interacțiunilor asociate cu BUB1 kinetohoramibelkov, BUBR1, MAD1 și MAD2 [105,106].
Sa dovedit că celulele tumorale sunt caracterizate prin modificări komponentovsverochnyh puncte ale ciclului celular, modificările sunt fie senzori sau efectori medieze oprirea ciclului celular. Astfel, inactivarea spindle asamblare punct de control, svyazannayas funcția încălcare MAD1 și MAD2 observate în unele cancer de san sluchayahraka si leucemie cu celule T cauzate virusomHTLV-1 (MAD1 este o țintă directă oncoprotein Brut acest virus) și BUB1 și mutațiile genei BUBR1 identificate sluchaevraka într-o mică parte a intestinului gros [83.105]. Cu toate acestea, crescând semnificativ o valoare pentru inactivarea unei supresoare tumorale protooncogene disfunktsiyanekotoryh și punctele de control ale ciclului celular, în chastnostir53, pRb, Myc și Ras (Fig. 6).

Fig. 6. "punctul de control" (Punctele de control) kletochnogotsikla și să participe la reglementarea anumitor oncogene supressorovi tumorii (explicații în text)
p53 este o componentă cheie a unor sverochnyh tochek.Kak menționate mai sus (a se vedea secțiunea 2) este activat ca raspuns o varietate de efecte adverse, inclusiv tulburări genetice privodyaschiek - pauze de ADN [28,59], lipsa pulanukleotidov [56], distrugerea microtubuli [98], în absența segregatsiihromosom mitozei [97] sau încetarea necorespunzătoare, formarea micronuclei privedsheek [98]. In acest caz senzori prejudiciu DNKyavlyayutsya evident protein kinaza ADN și / sau proteine ATM (ataxia-TeleangioectasiaMutated), au capacitatea, pe de o parte, capetele ADN raspoznavatsvobodnye iar celalalt - pentru fosforilarea p53 la Ser-15 prevenind astfel legarea acesteia proteină Mdm2, posleduyuschemutransportu și degradarea nucleului [14,28]. Senzori alte vysheupomyanutyhanomaly și căi de transmitere, atunci când un semnal la p53 ele sunt încă neclare.
O consecință este o schimbare în activarea genei p53 le ekspressiireguliruemyh, cum ar fi BAX, BCL2 și colab., Kontroliruyuschihapoptoz (vezi. Secțiunea anterioară) și p21WAF1, GADD45 (DNA Arrestand de creștere indusă de distrugere), a căror expresie conduce la un ostanovkekletochnogo ciclu [56.57 , 59]. Ca rezultat, celula în care uzheproizoshli sau poate să apară numai modificări genetice libogibnet un rezultat al inducerii apoptozei sau oprește vG1- sau G2-, și uneori în faza S a ciclului celular. Alegeți între reacțiile dvumyavozmozhnymi ale celulelor la activarea p53 - apoptoza si ciclul ostanovkoykletochnogo - depinde de mulți factori: celule gistogeneticheskogotipa (de exemplu, în fibroblastele normale, de regulă, există un oprirea ciclului celular, în timp ce apoptoza limfotsitah-), gradul de activare a p53 (cu creșterea apoptoză său nivel de probabilitate ekspressiipovyshaetsya), nivelul căii aktivnostisignalnogo funcțional p21WAF1-pRb-E2F, responsabil pentru G1 ostanovkuv (în fibroblastele inactivate sau p21WAF1 nablyudaetsyaapoptoz PRB) și t. d. [56,57,59] și oprirea tsiklaopredelyaetsya de celule punct în primul rând cele în care faza a celulei când celula tsiklanahoditsya intensifica expresia p53 [107] și kakimfaktorom cauzat activarea acestuia [56]. Violarea funcției p53, harakternyedlya mai diferite tumori umane, znachitelnooslablyayut funcții de control la punctele de control de celule tsiklai inhibă simultan inducerea apoptozei [106.108] care naryadus alte consecințe ale disfuncției p53, mecanismul chastnostiutratoy limitarea dopolnitelnyhtsentrosom formarea [109], crește foarte mult probabilitatea de proliferiruyuschihkletok cu spontan apar sau induse geneticheskimianomaliyami - modificări ale numărului de cromozomi [110-112] și lacrimă cromozomi irekombinatsiyami [110,112,113] sau amplificare otdelnyhgenov [112,114-116]. Este important să subliniem că reconstituirea normalnoyfunktsii p53 in celulele care au pierdut-o, dimpotrivă, duce la apariția tulburărilor umensheniyutempa genetice [111].
Destabilizarea genomului observate în încălcarea supresorii drugihopuholevyh, în special pRb. Cu toate acestea, în acest aspect gama sluchaechastota si modificari genetice in delyaschihsyakletkah semnificativ mai mic decat in celulele cu disfunctie p53. Acest lucru se datorează probabil faptului că inactivarea pRb atenueaza numai rabotusverochnoy punctul G1 (figura 6), dar nu în mod semnificativ afectează sverochnuyutochku în G2, și cel mai important - nu blochează apoptoza dependentă de p53 în anomalnyhkletkah.
Activarea unor proto-oncogene poate slăbi, de asemenea, puncte rabotusverochnyh ale ciclului celular (Fig. 6) și, în consecință, uvelichivatgeneticheskuyu instabilitate. De exemplu, supraexpresia Myc pozvolyaetpreodolet efect inhibitor asupra p21WAF1 cyclin D- Cdk4 și ciclina E - Cdk2, anulând astfel o oprire în G1, provoacă activarea p53. Hiperfuncția Ras poate lucra, de asemenea, puncte de control vyzyvatoslablenie în G1 și G2 și induc geneticheskuyunestabilnost, dar aceste efecte se pot manifesta numai in celulele care au anumite anomalii reglementate p53 cai de semnalizare [117].
Astfel, tumori maligne comune în supresoare izmeneniyaopuholevyh uman (inactivarea p53, pRb și vozmozhno, p16INK4a-p19ARF) și / sau protooncogene (activare Myc, Ras și, eventual, alte) duce la disfunctii ale ciclului celular de control și nestabilnostigenoma. In plus, celulele tumorale vyyavlyayutsyaizmeneniya natural si alte gene responsabile pentru genomului podderzhanietselostnosti. Mai mult decât atât, mutatsiine congenitale inactivare numai p53 sau pRb, dar, de asemenea, unele dintre gene repararea sistemneizmenno duce la dezvoltarea anumitor tumori. Etosvidetelstvuet rolul crucial al tumorilor vgeneze Instabilitatea genetică și / sau evoluția lor ulterioară. Desi genomului povyshennayanestabilnost probabil nu este tumorigeneza strict neobhodimoydlya, este practic imposibilă fără apariția unui număr suficient de mutații celulare apoase definind creștere zlokachestvennyyharakter a tumorilor solide. Crearea eterogenitate kletochnyhpopulyatsy, instabilitatea genetică în mod constant predostavlyaetmaterial pentru a lua mai mult și mai autonome și agressivnyhkletok.
 Apoptoza. Malignitatea celulelor corpului
Apoptoza. Malignitatea celulelor corpului Mecanisme de apoptoză și Regulamentul
Mecanisme de apoptoză și Regulamentul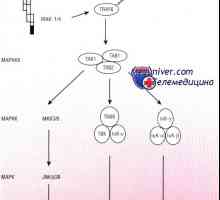 Răspunsul imun al epiteliului intestinal și bacterii calea de activare a apoptozei
Răspunsul imun al epiteliului intestinal și bacterii calea de activare a apoptozei Factorii care afectează apoptoza în celulele umane
Factorii care afectează apoptoza în celulele umane Oamenii de știință au descoperit o modalitate de a distruge celulele canceroase rezistente
Oamenii de știință au descoperit o modalitate de a distruge celulele canceroase rezistente Obstetrică și factori celulari ginekologiyarol in progresia cancerului de col uterin
Obstetrică și factori celulari ginekologiyarol in progresia cancerului de col uterin Hematologie efecte ale noii activității p53 mutante în ciclul celular, apoptoza și sensibilitatea…
Hematologie efecte ale noii activității p53 mutante în ciclul celular, apoptoza și sensibilitatea… Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya-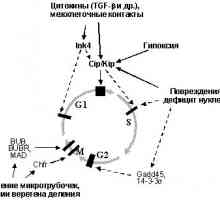 Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya-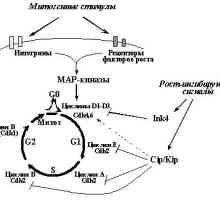 Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Medicină legală
Medicină legală
 Onkologiya-
Onkologiya- Răspunsul imun al epiteliului intestinal și bacterii calea de activare a apoptozei
Răspunsul imun al epiteliului intestinal și bacterii calea de activare a apoptozei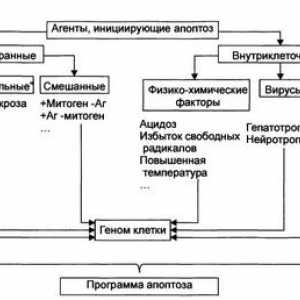 Factorii care afectează apoptoza în celulele umane
Factorii care afectează apoptoza în celulele umane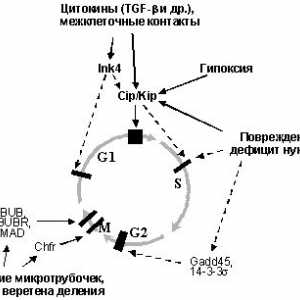 Onkologiya-
Onkologiya- Onkologiya-
Onkologiya-