Fiziologie foliculogeneza și ciclu menstrual

conținut
Ciclul menstrual este guvernat de o interacțiune complexă între axa hipotalamo-hipofizo-ovarian si uterin.
Dacă ați descrie pe scurt acest mecanism în hipotalamus produce hormonul de eliberare a gonadotropinei (GnRH), care stimulează producția de LH și FSH din glanda pituitară. Gonadotropine iniția procesul de maturare al ovocitului in ovar. În paralel cu aceasta, ovarele secreta hormonul care afectează endometru, pregătindu-l pentru implantare. In plus, hormonii ovarieni pe baza efectului de feedback asupra hipotalamusului și glandei hipofize, care reglementează secreția de gonadotrofine în timpul ciclului menstrual. Toate această interacțiune complexă este discutată în detaliu mai jos.
Hipotalamo-hipofizo sistem
GnRH este un inițiator central al funcției reproductive. GnRH este o peptidă de 10-amino, cu un timp de înjumătățire de 2-4 minute. Acesta este format din neuroni secretoare speciale, care apar în procesul de dezvoltare în placa olfactiv și apoi migreaza la hipotalamus mediabazalny. Acești neuroni situate în elevație medial și secretă un mod specific de impulsuri GnRH ( „generator de impulsuri“) în vasele portal care GnRH atinge gonadotrofy situat în adenohipofiză. GnRH se leagă de receptorii care aparțin superfamiliei de cuplat cu proteina G semidomennyh receptor transmembranar. 1,4,5-trifosfataza și acționează diacil-glicerol ca mesageri al doilea pentru GnRH. Frecvența pulsație a secreției de GnRH este sinteza reglementată și secreția gonadotropinelor hipofizare.
În timpul fazei foliculare de eliberare lentă a GnRH - la fiecare 90-120 de minute - activează secreția de FSH. Ca răspuns la stimularea cu FSH, foliculi de maturare în ovar secretes estradiol. Acest hormon realizează feedback-ul negativ și inhibă eliberarea produselor de reducere mediate FSH, GnRH prin neuronii care contin acid gamma-aminobutiric, în plus față de aceasta, poate exista un efect direct asupra glandei pituitare. Estradiolul este implicat într-un feedback pozitiv care crește frecvența pulsațiilor de GnRH la 60 de minute în faza foliculară, și, de asemenea, stimulează direct secreția de LH de către glanda pituitară. LH stimulează ovarele, astfel că există o creștere suplimentară a secreției de estradiol. Cu toate că în acest moment nu există nici o schimbare rapidă în pulsația de GnRH, estradiol, precum și alte mecanisme de reglementare pentru a crește sensibilitatea pituitara la GnRH. Această creștere a sensibilității duce la o creștere rapidă a producției de LH (vârf LH), care stimulează ovulația. Ca urmare a ovulației foliculul rupt (corpus luteum) produce progesteron. Acest hormon este implicat în bucla de feedback negativ, creșterea activității opioide endogene și poate scădea frecvența direct pulsația GnRH la 1 impuls timp de 3-5 ore. Astfel sinteza crescută de FSH în timpul tranziției luteale-folicular. Deoarece rata de reducere crește concentrația de progesteron GnRH pulsații, care promovează eliberarea de FSH.
Rolul glandei hipofize
Gonadotrofy aranjate în adenohipofiză și constituie priblizitelno10% din fondul total de celule pituitare. Aceste celule sintetizează și secretă LH și FSH. Acesti hormoni si tiroida-stimulator (TSH) și gonadotropina corionică umană (hCG) aparțin familiei de hormoni glico-proteine. Gonadotropinele - heterodimeri funcționale și constau din subunități alfa și beta. Secvența de aminoacizi a subunității alfa este identică pentru toți hormonii glicoproteici, în timp ce subunitatea beta se caracterizează printr-o compoziție de aminoacizi diferită, și conține informații unice.
Sinteza FSH și LH apare cel mai frecvent în aceleași celule. secretia de FSH este strâns legată de expresia subunității beta. Există o presupunere că, în gonadotrofah este stocul minim de FSH, și cea mai mare parte este secretată de cale constituțională. secreției de LH are loc în mod diferit: primul LH se acumulează în organite, iar apoi sub acțiunea factorului declanșator se realizează în eliberare (ajustare). Diferitele oligozaharide pe subunitatea beta poate furniza sortarea intracelular, rezultând mecanisme diferite de secreție.
Expresia diferențiată a genelor, ceea ce duce la producerea și eliberarea de celule gonadotropinelor adenohipofizare depinde de GnRH și hormoni ovarieni prin mecanisme de feedback. Slow frecventa GnRH pulsație crește expresia subunității beta a producției de FSH și crește amplitudinea A G. Pe de altă parte, o creștere a frecvenței GnRH ondulație activează expresia subunității beta a LH, crescând eliberarea de FSH. Ca rezultat, amplitudinea LH este redus, în timp ce concentrația sa medie crește plasmatice. Astfel, efectul de steroizi sexuali pe pulsația GnRH controlează indirect producția de gonadotropine pituitare anterioare.
În rețea vnutrigipofizarnoy mai multe mecanisme joacă un rol important în sinteza și secreția de gonadotropine. Gonadotrofy sintetizează și secretă peptide care aparțin familiei de factori de creștere de transformare (TRF). Activin este o proteină de reglementare locală, care este implicată în controlul gonadotrofov funcției. pulsație lentă a GnRH promovează sinteza activin, care, la rândul său, crește transcrierea FSH. pulsație rapidă de GnRH stimulează producerea de follistatin, o altă proteină înrudită-TRF, care se leagă activin. Aceasta reduce biodisponibilitatea sintezei FSH și activin redusă în mod corespunzător. În plus față de mecanismele de reglementare locale pentru exprimarea gonadotropinelor afectează factorii de creștere, cum ar fi transformarea ovarian inhibina.
Rolul ovarelor
Ovarele sunt strâns legate de procesul de reglare a ciclului menstrual, prin mecanisme de feedback. In plus, ovarele conțin rețeaua internă, inclusiv factorii care sunt sintetizate la nivel local și acționează ca o activitate gonadotrofică paracrin și regulatori autocrine. Prin intraovarialnym de reglementare includ familia de factori de creștere (IGF) familie asemănător insulinei și superfamilia TRF factorului de creștere epidermică (FER). Mai mult decât atât, acești factori sunt implicați în coordonarea dezvoltării foliculilor, ovulația și steroidogeneza.
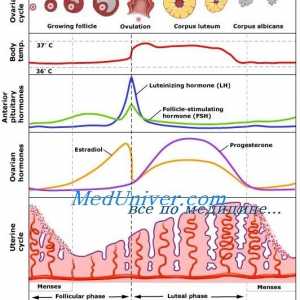
ciclu menstrual ovarian implica foliculara si faze luteale. fază foliculară se caracterizează prin creșterea foliculului dominant și ovulația. De obicei, este de 10-14 zile. Cu toate acestea, această fază poate varia considerabil în timp și depinde de lungimea ciclului menstrual la femeie la ovulație. faza luteala începe imediat după ovulație și este o perioadă în care ovarele produc hormoni care pot sprijini o posibila implantare. Durata acestei faze este relativ constantă la o medie de 14 zile (12-15 zile). Faza a ciclului menstrual va fi descrisă mai detaliat în secțiunea următoare.
foliculi primordiali sunt unitatea de reproducere de bază care cuprinde un bazin de „dormit“ ovocitului. Morfologic ele constau din ovocitele primare înconjurate de un singur strat de granuloase cu celule scuamoase si membranei bazale. Ei nu au nici o alimentare cu sânge. Aceste foliculi primordiale dezvolta între luna 6 și 7 gestație și reprezintă un stoc plin de foliculi ovarieni.
Dezvoltarea Folikulyarnoe incepe cu tranzitie „de somn“ foliculii primordiale în faza de creștere. Mecanismele precise care controlează introducerea inițială a fazei de creștere foliculară primordial nu a fost încă investigat până la sfârșitul anului. Se sugerează că piscina de foliculi rămase sub tonic constant „inhibare“ control. procesul de maturare primară conduce la inducerea creșterii unor foliculi primordiali, în timp ce foliculii vecine rămâne inactiv timp de luni și chiar ani. Se presupune că activarea progresivă a foliculilor este un proces lung, care începe imediat după formarea pool de celule embrionare și se termină cu epuizarea unității folicular. Acest proces complicat nu este dependent de gonadotropine. Pe baza mai multor studii au sugerat că includerea procesului de dezvoltare a foliculului primordial întâlnește sistem de avertizare intraovarian, care include unii membri ai familiei de TRF. De asemenea, este cunoscut faptul că pentru creșterea și dezvoltarea corespunzătoare a primordială
celulă folicul necesită un contact strâns cu celulele granuloase și ovocitul. Aceste celule prin decalaj de poduri trece familia conexină la și de ovocite de diverși factori, nutrienți și produși de descompunere.
Există o teorie care ovocitul în sine afectează moartea sa, secretând diverși factori. Acest proces implică producerea de doi factori de creștere legate de TRF- sunt produse de ovocite in dezvoltarea foliculului timpuriu, factor de diferențiere de creștere (RDF) -9 și proteină morfogenetică osoasă (BMP) -15. Într-un studiu privind cu receptorii cu handicap soareci au aratat ca ovocitului activeaza proliferarea celulară granuloase prin acești factori de creștere ca răspuns la granuloase celule produc factori (de exemplu, follistatin, kit-ligand) care reduce efectul inhibitor (de exemplu, Inhibin A, Mullerian substanța de inhibare) și contribuie la stimularea creșterii ovocitului.
Până în prezent, descrie o serie de factori locali, și în viitor va fi găsit un număr mare de ele. Studiul continuă a acestor factori de creștere și hormoni va ajuta la determinarea fiziologia procesului de revitalizare a foliculilor primordiale. Numărul de celule terminale este limitat, iar fiecare maturarea completă a foliculilor reduce celulele de rezervă. Orice boală care duce la terminalul redus de celule sau pot accelera activarea folicul poate duce la epuizarea foliculare timpurii și, astfel, la încetarea prematură a funcției reproductive.
Dezvoltarea foliculului primar este prima etapă a creșterii foliculare. folicul primar de mai multe caracteristici diferite primordiale. Ovocitelor începe să crească. O parte a procesului de creștere este formarea zonei clare (zona pellucida). Acesta constă dintr-un strat gros de glicoproteine care sunt cel mai probabil sintetizate ovocitului. Acest strat înconjoară complet ovocitul și o barieră între celulele ovocitului și granuloase. Se efectuează o serie de funcții necesare pentru protecția și fertilizarea ovocitului. Ca urmare, celulele granuloase sunt supuse unei serii de modificări morfologice ale scuamos la cub. Această etapă de dezvoltare poate dura până la 150 de zile.
Trecerea la foliculi secundari se produce atunci când dimensiunea maximă a ovocitelor (120 nm diametru), granuloase de proliferare a celulelor și apariția celulelor tecale. Mecanismul exact al celulelor tecale apariție insuficient studiate, dar se presupune că acestea sunt formate din mezenchim ovarian adiacent (fibroblaști stroma) așa cum se misca in creier a dezvolta substanta foliculului ovarian. Dezvoltarea acestui strat face posibilă formarea Teke interior și exterior. Odată cu dezvoltarea celulei folicul tecale primește o alimentare cu sânge, în ciuda faptului că stratul de celule de granuloasă nu rămân vaskulyarizirovanymi. Celulele granuloase produc folicul secundar la FSH receptori, estrogen și androgen. Această fază poate dura până la 120 de zile, poate că acest lucru se datorează perioadei lungi de dublare celulele granuloase (>250 ore).
Dezvoltarea ulterioară conduce la formarea unui antral folicul terțiar sau fază incipientă. Această fază este caracterizată prin formarea de antrum sau cavități în folicul. lichid antrală conține steroizi, proteine, electroliți, proteoglicani, precum ultrafiltrat, care este format prin difuzie prin placa de bază. Această fază este caracterizată prin diferențierea suplimentară a celulelor tecale. Subpopulatii celule tecale interstițiale dezvolta în cadrul tecale interne conțin receptori pentru LH și să furnizeze steroidogeneza celulei. Apoi începe diferențierea celulelor granuloase. Deoarece placa bazale, celulele sunt împărțite în grupe, după cum urmează: strat periantralny membrană ovipar tubercul și corona radiata. producție influențele dezvoltării de FSH și a semnalelor neidentificate primite de la ovocit. Se presupune că factorul dependent de ovocit (RDF-9) este o componentă integrantă a procesului. Modificarea concentrației RDF-9 afectează formarea unui strat. De asemenea, celulele granuloase ca răspuns la stimularea cu FSH produc activin, care este un membru al FAT. Activin este format din două subunități variante: A și B, care sunt interconectate prin legături disulfidice. Diferite combinații ale acestor subunități dă naștere la diferite activin (activinul A [A, A] AB [A, B], sau IV [V, B]). Mai degrabă, activins sunt hormoni, deoarece concentrația lor în sânge este constantă și este independent de ciclul menstrual și fracția liberă în sânge nu este determinat. Rolul principal al aktivinina este prin activarea receptorului de FSH în celulele granuloase și creșterea foliculogeneza.
Creșterea în faza de folicul antral timpurie se realizează într-un ritm lent și constant. Foliculii atinge un diametru de 400 nm. Primar factor de creștere a foliculului în această etapă, este stimulată de FSH celule granuloase mitoze. Până în acest punct supraviețuirea și dezvoltarea foliculilor sunt în mare măsură independente de gonadotropine. În prepubertal și la femeile care iau contraceptive, în acest stadiu de foliculi sunt în diferite stadii de dezvoltare. În acest stadiu al foliculogeneza pentru creșterea lor în continuare și de dezvoltare, trebuie să aveți FSH. În cazul în care nu este suficient de FSH, foliculi supuse involuție.
unitate morfologică - folicul, format din celule tecale si granuloase este, de asemenea, o unitate independentă de hormon care este responsabil pentru producția de estrogen. Celulele tecale și granuloase se află sub influența directă a LH și FSH respectiv. Gonadotropinele crește producția de cAMP și activitatea factorului de transcripție FS-1 în celulele respective. Celulele din tecale expuse la LH este crescută LH-receptor de pe suprafața celulei și o expresie crescută și activitatea StAR, P450scc, RR-HSD-II, P450c17 necesare pentru a crește producția de androgeni. FSH crește producția de aromataza cu celule granuloase și 17p-HSD.
Androgenii pot fi formate într-una din cele două căi: calea D5, în care este utilizat ca DHEA precursor, și calea D4 - sinteza androgen a 17-OH-progesteron. Cu toate acestea, calea D4 uman este reprezentat de minim. Acest lucru se datorează faptului că 17,20-liaza are o afinitate mult mai mare pentru 17-OH-pregnenolonă decât 17-OH-progesteron. Astfel, principalul precursor al hormonilor sexuali la om este DHEA.
Androgenii, în principal, androstendion, trec prin foliculului placa de bază și devine un precursor major al estrogenilor. cale biosintetice Estradiol determinată de 17p-HSD tip. Omul a fost identificat șapte tipuri de 17P-HSD, fiecare dintre care are o afinitate pentru anumiți steroizi. In celulele granuloase, reprezentate în principal 17p-HSD tip 1, care reduce molecula estronă, convertindu-l în estradiol. 17p-HSD tip 3 este detectat în principal în celulele Leydig și promovează trecerea androstendion in testosteron. 17P-HSD tip 5 este în celulele tecale și promovează, de asemenea, trecerea androstendion in testosteron. Astfel, principala cale de biosinteză estradiol se efectuează în celulele granuloase în timpul aromatizarea androstendionei la estronă, implicând aromataza si reducerea ulterioara a estronei moleculelor de estradiol care implica 17P-GSD1 tip 1.
Video: Ciclul menstrual este 2/2
} {Modul direkt4
Necesitatea de a participa la estradiol folicul, precum și mecanismele de feedback pozitiv și negativ la glanda pituitara studiată suficient. Cu toate acestea, rolul de estrogen în procesul de maturizare locală și de creștere a foliculului rămâne controversată. Este evident că estrogenii sunt sinergice cu FSH în faza foliculară, deoarece acestea cresc expresia receptorilor pentru LH și FSH stimulează proliferarea celulelor granuloase și potențează activitatea aromatazei. Pe baza unui studiu efectuat pe șoareci cu activitate de aromataza cu handicap, s-a sugerat rolul de estrogen locale. În primul rând acești șoareci au avut foliculi antral, dar după un an, nu a fost descoperit nici un foliculi antral sau secundare și atrezia supuse unei primordiale. Cu toate acestea, aceste ovocite șoareci pot maturiza in vitro și pentru a forma un blastocist. Este evident că există receptori de estrogen in celulele granuloase si celule tecale. Studiile efectuate la șoareci cu receptori -estrogenovymi cu handicap au arătat că acești șoareci sunt infertile și nu au bule graafovyh. În acest caz, mouse-ul cu receptorii -estrogenovymi cu handicap sunt capabili să aibă copii. La om, există cazuri de dezvoltare foliculară în absența secreției de estradiol în organism. Un astfel de caz a fost observată la femeile cu un deficit de 17a CYP, care creșterea foliculară a fost marcată cu introducerea de gonadotropine. Fertilizarea in vitro a fost marcată de creștere a embrionului, dar, din păcate, nu a avut loc sarcinii.
Factorii Vnutriovarialnye joacă un rol esențial atât în foliculului și în steroidogeneza. factor-a produs ovocit RDF-9 a lansat pe parcursul foliculogeneza proces. Se crede că acest factor este rulează nu numai diferențierea celulelor granuloase, dar, de asemenea, are un efect stimulator asupra celulelor tecale și inhibarea formării celulelor corpului galben. Studiile in vitro au arătat că IRF-1 și IRF-2 îmbunătățită proliferarea celulelor granuloase și a secreției de estradiol. Cu toate acestea, s-a sugerat că în procesul de maturizare a rolului dominant foliculară jucat de IGF-2 în loc de IGF-1. Acest fapt poate fi explicat prin lipsa exprimării IGF-1 în celulele granuloase ale foliculului dominant. Mai mult, femeile cu sindrom Laron (absența IGF-1) este posibilă stimularea ovulației cu gonadotropine. Acest fapt sugerează că prezența IGF-1 nu este un factor necesar în foliculogeneză.
Celulele granuloase produc alti hormoni care regleaza foliculogeneza, de exemplu, sintetizat subunitate care se leagă la subunitatea și formează heterodimeri cunoscut sub numele de Inhibin A (A) sau Inhibin B (B). Rolul inhibina în steroidogeneză foliculului și indirecte, prin suprimarea producției de FSH de către glanda pituitară. Concentrația de inhibina A și B depind de ritmul menstrual. Circulantă inhibin Un nivel este crescut în faza foliculară tardivă și rămâne ridicat în toate Teneev nou-lyutey, în timp ce concentrația de inhibina B specularly reflectă concentrația de FSH. Deși nivelurile de inhibina în creșteri serice, respectiv crește dimensiunea celulelor granuloase ca răspuns la stimularea cu FSH în concentrație de inhibin foliculară nu depinde de mărimea foliculului. Sa sugerat că concentrația de ser inhibina B reflectă cantitatea de celule granuloase și poate servi ca un indicator al creșterii rezervei ovariene. Deoarece Inhibin B este un inhibitor principal al producției de FSH de către glanda pituitară în faza foliculară în absența estradiol, măsurarea nivelelor bazale de FSH poate fi un marker indirect al rezervei ovariene.
Faza de antrală se caracterizează prin creșterea foliculară intens (1-2 mm / zi) și depinde de concentrația de gonadotropine. Ca răspuns la stimularea FSH creste folicul antral rapid și atinge 20 mm în diametru, în principal datorită acumulării antrală fluid. Celulele tecale continuă să se diferențieze în interstițial care produc un număr tot mai mare de androstendion pentru aromatizarea ulterioare estradiol. Celulele granuloase continuă să se diferențieze una de alta. Strat cu membrană sub influența FSH dobândi receptori pentru LH. Aceasta diferă de stratul de membrană strat cumulativ în care nici receptorii de LH. Dezvoltarea finală a unui folicul matur este un proces selectiv, prin care cele mai multe ori se dovedește un folicul dominant gata pentru ovulatie.
Procesul de selecție începe în faza Iuțeală intermediară a ciclului precedent. A crescut de estrogen determină amplificarea preovulatorie FSH-activitate în cadrul foliculului, în timp ce principiul feedback-ului împiedică producerea de FSH hipofizar. secreția pituitară redusă de FSH conduce la încetarea de sprijin gonadotropină foliculi antral mai mici, ceea ce duce la atrezia lor. În ciuda scăderii concentrației de FSH, foliculul dominant continuă să crească, creșterea masei de celule de granuloasă, cu un număr mare de receptori pentru FSH. Celulele crescute vascularizația tecale ofera o livrare selectivă a FSH la folicul dominant, în ciuda scăderii concentrațiilor serice de FSH. Nivelurile crescute de estrogen din foliculul facilitează activarea hormonului foliculostimulant celular al receptorului LH granuloasă, care permite foliculul să răspundă la eliberarea ovulatorie L G. In absenta receptorilor de estrogen la LH celulele granuloase nu au dezvoltat pe suprafață.
LH val este o condiție absolută pentru ovulației și maturarea ovocitului. Producția crescută de LH în mijlocul ciclului se datorează sensibilității crescute a glandei pituitare la GnRH. Sensibilizarea este cauzată de feedback-ul pozitiv între concentrațiile de creștere și estrogen exponențială poate inhibin A. Rezultatul acestei descărcării devine reluarea meiozei în ovocitului I pentru a elibera corpul polar imediat inainte de ovulatie. Există motive să se presupună că celulele granuloase secreta inhibitor ovocitului de maturare (ISO), care interacționează cu cumulus oophorus și astfel blochează procesul meiotice în timpul foliculogeneza. Teoretic, se consideră că ISO isi exercita efectul prin blocarea eliberării cAMP în cumulus oophorus, care pătrunde în maturarea și se oprește meiotice ovocitului. LH val depășește ISO blocarea acțiunii, reducerea concentrației de cAMP și creșterea concentrației de calciu intracelular, permițând reluarea meiozei.
Imediat înainte de ovulație, creșterea producției de progesteron, care, în parte, și este cauza vârfului de FSH în mijlocul ciclului. Vârful FSH stimulează producerea de cantități adecvate de receptori de LH pe celulele granuloase. FSH, LH și progesteron induce expresia enzimelor proteolitice care descompun colagenul în peretele folicular și deteriorarea acesteia. Crește producția de progesteron, deci poate exista o reducere a celulelor musculare netede, care cresc expulzarea ovocitului.
LH val dureaza aproximativ 48-50 ore. 36 de ore după începerea eliberării LH are loc ovulatia. Semnalul de feedback pentru oprirea emisiei de un necunoscut T. Poate concentrații crescute de mecanism de feedback negativ progesteron inhibă secreția de pituitare GnRH prin reducerea frecvenței pulsație. Imediat înainte de ovulație suprimă, de asemenea, activitatea LH receptori proprii care reduc activitatea hormonului de unități funcționale. Ca urmare a producției reduse de estradiol.
După ovulație, și ca răspuns la LH, celulele granuloase și celulele tecale interstițiale rămase în foliculul ovulat se diferențiază în celule granulezo- și tecale luteina, respectiv, formând corpus luteum. LH induce, de asemenea, producerea factorului de creștere al endoteliului vascular (VEGF), care joacă un rol important în dezvoltarea corpus luteum rețelei vasculare. Vasele nou formate penetrează membrana bazală, cât și prin biosinteză progesteron activat de LDL în celulele luteina granulosa. După ovulație activează receptorii de LH din celulele luteale folosind un mecanism necunoscut. Acesta este un factor crucial în menținerea LH bazale pentru a păstra corpul galben.
Pentru hormonul luteum interacțiune necesare tecale luteină și celulele granuloase luteina, precum și în folicul preovulatorie. Ca răspuns la LH și hCG, celulele tecale celulele luteina pentru a spori expresia enzimelor implicate în sinteza androstendionei. In celulele luteina granuloase, cu participarea LH crește activitatea aromatazei pentru aromatizarea de androgeni la estrogeni. Diferența principală dintre-luteina celulele granuloase ale celulelor granuloase preovulatorie este de a induce exprimarea P450scc și Sp-HSD, care permite celulelor de a sintetiza progesteron. secreție
Progesteronul și estradiol apare sporadic și se corelează cu creșterea secreției de LH. FSH-ul are un impact minim asupra producției de progesteron, cu toate acestea, aceasta continuă să stimuleze producția de estradiol în faza Iuțeală. progesteron crește concentrația și atinge maximul la aproximativ în ziua a 8-a fazei luteale care durează aproximativ 14 zile.
Procesul de dezvoltare inversă a corpului galben (moarte celulară programată) începe la aproximativ 9 zile dupa ovulatie. Mecanisme de involuție a corpului galben nu este pe deplin înțeles. De îndată ce lyuteolizis începe o scădere rapidă a concentrațiilor de progesteron. Pe baza mai multor studii, puteți asuma rolul de estrogen în lyuteolizise. Acest lucru a fost demonstrat prin administrarea directă a estrogenilor în ovar care conține corpus luteum. Ea poate fi făcută pe baza datelor experimentale, presupunerea că chiar înainte de lyuteolizisom în corpus luteum este procesul de activare a activității aromatazei. Creste activitatea aromatazei apare ca răspuns la stimularea cu gonadotropine (LH și FSH), în timp ce în faza Iuțeală, cel mai probabil, FSH joacă un rol important. Astfel, există o scădere a activității de Sp-HSD. Această reducere poate duce la reducerea concentrației de progesteron și respectiv la lyuteolizisu. Mai mult, modulatorii locali, cum ar fi oxitocina, produs de celulele corpus luteum sunt implicate în sinteza progesteronului. Alți cercetători susțin rolul de prostaglandine în Ljuta-liza. Datele experimentale sugerează că PGF2a, care este secretat in uter sau ovar in timpul fazei luteale, stimularea citokinelor, cum ar fi factorul de necroză tumorală (TNF), având ca rezultat apoptoza care are loc și, în consecință, degradarea corpus luteum.
Este cunoscut faptul că enzimele proteolitice implicate in lyuteolizisa proces. Se presupune că în procesul de lyuteolizisa activității metaloproteinazelor matriciale crescută. Generarea unui modulator cunoscut al matricei metaloproteinazei este hCG. Acest fapt poate juca un rol important în primele etape ale sarcinii, atunci când hCG previne regresia corpus luteum. Cu toate acestea, în absența corpului luteal de sarcină este redusă, ceea ce conduce la scăderea concentrației de progesteron, estradiol și inhibina A. Reducerea concentrației acestor hormoni duce la o creștere a secreției de GnRH și FSH pulsație. Creșterea concentrației de FSH stimulează următoarea cohorta de foliculi si induce un nou ciclu menstrual.
Rolul uterului
Funcția principală a uterului este plasarea și menținerea vieții fetale. Endometrul - stratul interior al uterului, care se diferențiază în timpul ciclului menstrual, astfel încât să poată reține și hrăni embrionul. Histologic endometru reprezentat epiteliului formarea glandei și construi-mină, care conține fibroblasti stromale și matricea extracelulară. Endometrul morfologic împărțit în două straturi: bazală și funcțional. stratul bazal se invecineaza direct miometrului și cuprinde prostată, precum și recipientele de sprijin. Acesta furnizează componentele necesare pentru dezvoltarea stratului funcțional. Stratul funcțional este un strat dinamic care se regenerează în fiecare ciclu ulterior. In acest strat se poate produce blastocysts implantare.
In timpul ciclului menstrual, dezvoltarea endometrului apare ca răspuns la stimularea ovarelor cu hormoni. Ca și alte organe endocrine, uterul contine o serie de factori locali care modulează activitatea hormonală. Faza endometru coordonat cu faze ovulatorii. In timpul fazei foliculare, faza proliferative endometru trece. Acesta începe de la debutul menstruatiei si se termina cu ovulația. In timpul fazei luteale endometru trece secreție. Acesta începe în timpul ovulației și se termină chiar înainte de menstruație. În cazul în care nu se produce implantare, vine o fază degenerativă. In aceasta faza trece menstruație. Următoarea fază a endometrului vor fi luate în considerare mai detaliat.
In timpul fazei foliculare, estrogenii sunt ovarele produc care stimuleaza glandele din stratul bazal la formarea stratului funcțional. Estrogenii au contribuit la creșterea expresiei genelor de diferite citokine și factori de creștere, incluzând ORF, TRFos și IGF. Factorii de creștere a crea un micromediu în endometrul pentru a spori efectul de hormoni. La inceputul ciclului menstrual, endometrul este subțire, în mod tipic mai mică de 2 mm. glande endometriale și linii subțiri, și trimise de stratul bazal la suprafața interioară a cavității uterine. După cum stroma și endoteliul apar receptorii de estrogen și progesteron. vasele de sange spiralate din stratul bazal prin graba stroma pentru a menține alimentarea cu sânge a endometrului. In cele din urma strat funcțional acoperă cavitatea uterină întreg și atinge 3-5 mm grosime (grosime totală 6-10 mm). Această etapă se numește proliferativă.
Dupa ovulatie, ovar produce progesteron, care inhibă proliferarea în continuare a endometrului. Aceste mecanisme pot fi implementate folosind antagoniști ai receptorilor de estrogen. Progesteronul dezactiveaza receptorii de estrogen și promovează metabolismul estradiol in endometru prin stimularea activității 17p-HSD conversia estradiolului și a metabolitului său activ mai puțin de estronă. In timpul fazei luteale a glicogenului epiteliului glandular se acumuleaza si incepe sa secrete glicopeptide și proteine în cavitatea uterină. Acesta este substratul lichid care susține libera circulație a care este în blastocist. Progesteronul stimulează, de asemenea, diferențierea endometrului și provoacă modificări histologice. Glandele devin considerabil mai răsucire, navele spirală devin chiar mai răsucite și să ia forma unui tirbușon. Stroma devine foarte antiedematos rezultând o permeabilitate capilară crescută. Celulele se uite la scară mărită și poliedrică. Acest proces este numit predetsidualizatsiya. Aceste celule sunt foarte active, și răspund bine la impulsuri hormonale. Ele produc prostaglandine, împreună cu alți factori implicați în menstruație, implantare si sarcina. Această fază se numește secretorie.
Dacă nu există nici implantarea embrionului, începe faza degenerativă. Estrogenii și progesteron determina producerea de prostaglandine PGF2a și PGE2. Prostaglandinele, la rândul său, determină o vasoconstricție progresivă și relaxare a navei în spirală. reacții vasomotorii provoca ischemie endometriale și leziunea de reperfuzie. In cele din urma, in cadrul endometrul se dezvolta sangerare cu formarea hematomului. Progesteronul activează declanseaza activitatea MMP care contribuie la degradarea matricei extracelulare. Ca progresia ischemie-TION și degradare, necrotizante strat funcțional și este evacuat împreună cu menstruației ca sânge și endometru. Pierderea de sange in timpul menstruatiei normale este de aproximativ 25 până la 60 ml. În ciuda faptului că PGF2a este un stimulator puternic al miometrului și, astfel, reduce sângerarea postpartum, aceasta nu afectează sangerari menstruale. Mecanismul de bază implicate în limitarea pierderii de sânge sunt trombina tub si asociate estrogen rana re-epitelizarea prin stratul bazai al endometrului, care începe în faza foliculară timpurie a următorului ciclu menstrual.
Dacă concepția sa produs, implantare poate avea loc în endometru în faza mid-secretorie (luteale). In acest moment endometru are o grosime suficientă și furnizarea de nutrienți. Sincitiotrofoblast secreta direct hCG, care stochează și menține secreția de progesteron corpus luteum necesară pentru dezvoltarea completă a decidua endometriale.
Astfel, două faze trece de ovar in timpul ciclului menstrual: foliculara si luteala. Endometrul - cele trei faze, care sunt sincronizate cu fazele ovarelor. Aceste mecanisme complexe de feedback între ovare și axa hipotalamo hipofizar reglarea ciclului menstrual. In timpul fazei foliculare, ovarele secreta estradiol, care stimulează endometrul. Dupa ovulatie (faza luteala) ovarele produc estrogen și progesteron, care activează îndreptarea endometrului și pregătirea acesteia pentru faza secretorie. Într-un ciclu care nu se termină sarcina se dezvoltă lyuteolizis, ceea ce duce la încetarea producției de hormon. Acest hormon de eliberare pauză conduce la o fază degenerativă și începutul menstruației.
Video: Ciclul menstrual. Hormoni. ovulația
 Ciclul ovarian. fază foliculară a ciclului ovarian
Ciclul ovarian. fază foliculară a ciclului ovarian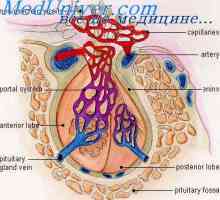 Controlul hipotalamo hipofizar. vasele de sange hipotalamo-hipofizo
Controlul hipotalamo hipofizar. vasele de sange hipotalamo-hipofizo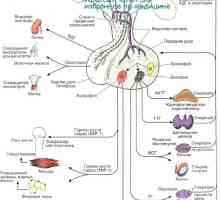 Fiziologia glandei pituitare. hormoni hipofizari
Fiziologia glandei pituitare. hormoni hipofizari Reglementarea funcțiilor sexuale ale corpului masculin. hormon eliberator de gonadotropină
Reglementarea funcțiilor sexuale ale corpului masculin. hormon eliberator de gonadotropină Suprimarea sintezei de hormoni masculini. Regulamentul spermatogenezei
Suprimarea sintezei de hormoni masculini. Regulamentul spermatogenezei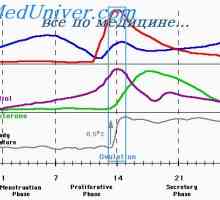 Reglementarea ratei lunare sexuale feminine. hormoni sexuali feminini
Reglementarea ratei lunare sexuale feminine. hormoni sexuali feminini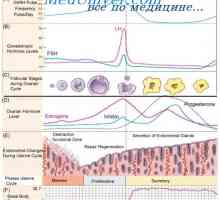 Hormoni ovulație. Hipotalamo-hipofizo-ovarian anterior
Hormoni ovulație. Hipotalamo-hipofizo-ovarian anterior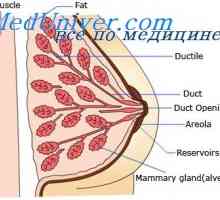 Reglementarea secreției de prolactină. Separarea laptelui sub acțiunea oxitocinei
Reglementarea secreției de prolactină. Separarea laptelui sub acțiunea oxitocinei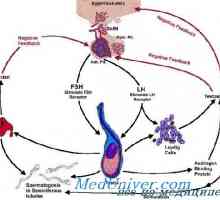 Hipotalamus. Hormonului de eliberare a gonadotropinei funcția (GnRH)
Hipotalamus. Hormonului de eliberare a gonadotropinei funcția (GnRH)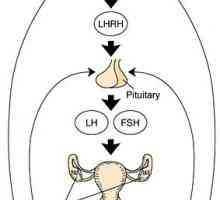 Sistemul hipotalamo-hipofizo-ovarian. caracteristici de vârstă
Sistemul hipotalamo-hipofizo-ovarian. caracteristici de vârstă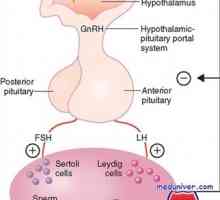 Hormon (GnRH) eliberator de gonadotropină. Funcții și Sinteză
Hormon (GnRH) eliberator de gonadotropină. Funcții și Sinteză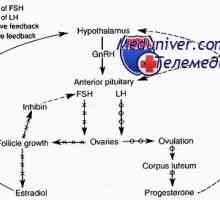 Ovarul ca un organ endocrin. Teoria cu două celule
Ovarul ca un organ endocrin. Teoria cu două celule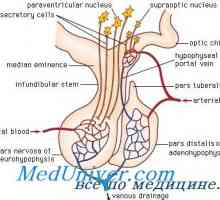 Inhibina și funcția activin. follistatin
Inhibina și funcția activin. follistatin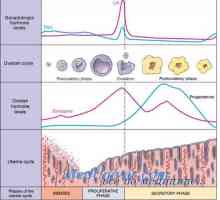 Fazei luteale a ciclului menstrual. regulament
Fazei luteale a ciclului menstrual. regulament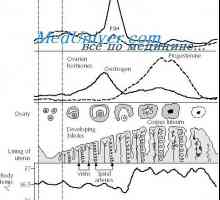 Tranziția fazei luteale foliculare a ciclului menstrual. regulament
Tranziția fazei luteale foliculare a ciclului menstrual. regulament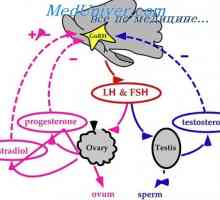 Mecanismele de debutul pubertății. Înțeles țesut adipos
Mecanismele de debutul pubertății. Înțeles țesut adipos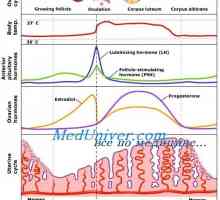 Ovulatorie a ciclului menstrual. regulament
Ovulatorie a ciclului menstrual. regulament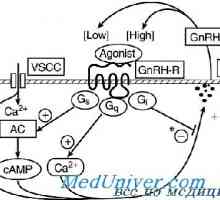 Receptor pentru a gonadotropinei de eliberare a hormonului. receptor Mutațiile GnRH
Receptor pentru a gonadotropinei de eliberare a hormonului. receptor Mutațiile GnRH Glande și hormoni sexuali
Glande și hormoni sexuali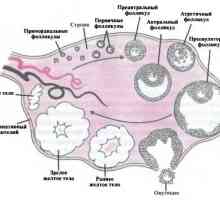 Anatomia și fiziologia sistemului de referință reproductiv feminin
Anatomia și fiziologia sistemului de referință reproductiv feminin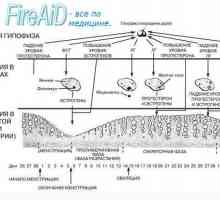 Ciclul menstrual (ciclul lichid mamă). Faza a ciclului menstrual. faza menstruală. fază…
Ciclul menstrual (ciclul lichid mamă). Faza a ciclului menstrual. faza menstruală. fază…
 Ovulatorie a ciclului menstrual. regulament
Ovulatorie a ciclului menstrual. regulament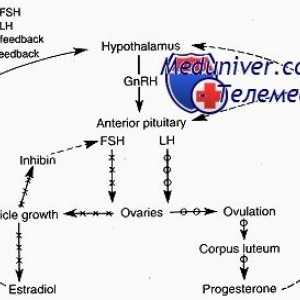 Ovarul ca un organ endocrin. Teoria cu două celule
Ovarul ca un organ endocrin. Teoria cu două celule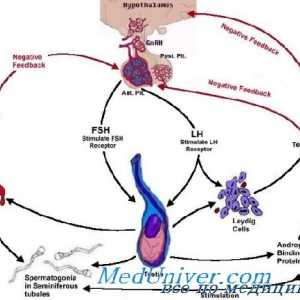 Hipotalamus. Hormonului de eliberare a gonadotropinei funcția (GnRH)
Hipotalamus. Hormonului de eliberare a gonadotropinei funcția (GnRH) Glande și hormoni sexuali
Glande și hormoni sexuali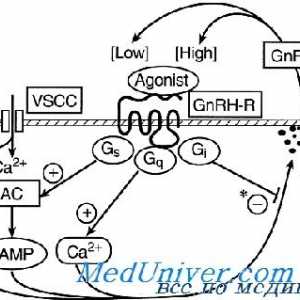 Receptor pentru a gonadotropinei de eliberare a hormonului. receptor Mutațiile GnRH
Receptor pentru a gonadotropinei de eliberare a hormonului. receptor Mutațiile GnRH Suprimarea sintezei de hormoni masculini. Regulamentul spermatogenezei
Suprimarea sintezei de hormoni masculini. Regulamentul spermatogenezei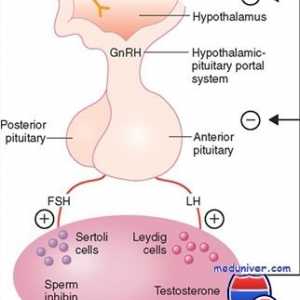 Hormon (GnRH) eliberator de gonadotropină. Funcții și Sinteză
Hormon (GnRH) eliberator de gonadotropină. Funcții și Sinteză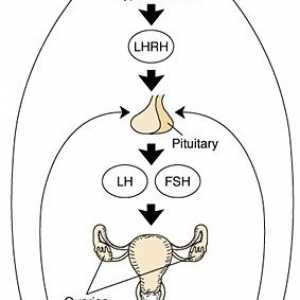 Sistemul hipotalamo-hipofizo-ovarian. caracteristici de vârstă
Sistemul hipotalamo-hipofizo-ovarian. caracteristici de vârstă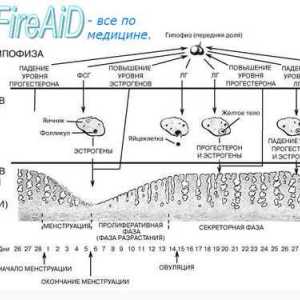 Ciclul menstrual (ciclul lichid mamă). Faza a ciclului menstrual. faza menstruală. fază…
Ciclul menstrual (ciclul lichid mamă). Faza a ciclului menstrual. faza menstruală. fază…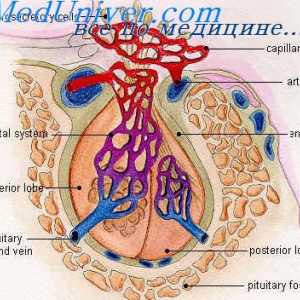 Controlul hipotalamo hipofizar. vasele de sange hipotalamo-hipofizo
Controlul hipotalamo hipofizar. vasele de sange hipotalamo-hipofizo