Regulament și tulburări ale echilibrului acido-bazic
Video: Neumyvakin echilibrul acido-bazic
conținut
- Video: neumyvakin echilibrul acido-bazic
- Fiziologia echilibrului acido-bazic
- Echilibrului acido-bazic
- Video: echilibrul acido-bazic al corpului profesorului alcalinizare fără discriminare
- Video: fiziopatologia metabolismului glucidic (lecture). t.n.0 alhendi. partea 1/2
- Violarea echilibrului acido-bazic
- Video: oamenii de știință au descoperit un regulator al echilibrului acido-bazic
- Clasificare
- Simptome și semne
- Diagnosticare

În procesul de metabolizare se formează în mod constant acizi și baze.
ion de hidrogen (H +) este reaktiven- în particular se leagă de încărcat negativ fibre și, dacă sunt prezente în concentrație mare, se modifică taxa lor totală, configurația și funcția. Prin urmare, există mecanisme în organism menținerea concentrației de H + în intervalul îngust - 37-43 nmol / L. Încălcarea acestor mecanisme poate avea consecințe clinice severe.
echilibrul acido-bazic este strâns legată de încălcarea obmenom- hidroelectrolitic unuia dintre acestea afectează de obicei cealaltă.
Fiziologia echilibrului acido-bazic
Cele mai multe dintre acizii formați în timpul metabolismului carbohidraților și a grăsimilor, în timpul care a produs zilnic de la 15 000 la 20 000 mmol CO2. Prin ea însăși, CO2 acidul nu este, dar care interacționează cu apă (H2O) din sânge, este transformat în acid carbonic (H2CO3). În sfârșit, în prezența enzimei anhidraza carbonică disociază în +NSO3-. H+ Acesta se leaga cu hemoglobina din eritrocite și este eliberat după oxigenare a sângelui în alveolele pulmonare, unde reacția inversă are loc pentru a forma H2O și CO2- CO2 excretate în timpul fiecărui expiratie.
cantități mai mici de acizi organici sunt formate prin:
- metabolizarea incompletă a acizilor grași și ale glucozei (conversia acestora în acizi lactici și ceto);
- metabolismul conținând sulf aminoacizi (cisteină, metionină) pentru a forma acid sulfuric;
- metabolismul acizilor încărcați pozitiv aminoacizi (arginina, lizina);
- hidroliza fosfați, consumate cu alimente.
Acest „fix“ sau sarcină acidă metabolic nu apare în respirație și, prin urmare, trebuie neutralizate sau excretat fie prin tractul gastro-intestinal și rinichi.
Cea mai mare parte a bazei este produsă în timpul metabolismului aminoacizilor anionici (glutamat și aspartat) și consumul de anioni organici, cum ar fi lactat și citrat, care se formează în timpul oxidării HCO3-.
echilibrului acido-bazic
echilibrul acido-bazic este menținut prin sisteme de tamponare chimice și excreția excesul de acizi sau baze, prin plamani si rinichi.
Video: echilibrul acido-bazic al corpului profesorului alcalinizare fără discriminare
sisteme tampon chimice. Sistemul de tamponare chimic - această soluție, amortizare modificări ale pH-ului. Intra - sisteme tampon și extracelulare pentru a reacționa imediat la încălcarea echilibrului acido-bazic. O funcție importantă tampon este realizată și oasele. Sistemul tampon constă dintr-un acid slab și baza asociată. Baza se atașează H+, un acid slab este deconectat și astfel minimizează schimbarea concentrației libere H+.
Creșterea concentrației unei ecuații drept iminentă, adică Ea produce mai mult CO2. Concentrația de CO2 alveolele ventilate controlate, iar concentrația de H+ și HCO3- excreția renală.
Relația dintre TVA3- și CO2 sistemul poate fi descris de ecuația Cassirer - Bleich derivate ecuațiile Henderson - Felix Gasselich-Balho: H+= 24hPCO2/ TVA3-
Această ecuație arată dependența echilibrului acido-bazic al relației PCO2NSO3-, mai degrabă decât valorile absolute ale fiecărui indicator. Folosind această formulă, valorile pentru oricare doi indici (în mod tipic H+ și PCO2) Poate fi calculată a treia valoare (de obicei, NSO3-).
Video: Fiziopatologia metabolismului glucidic (Lecture). T.N.0 Alhendi. partea 1/2
Alte sisteme importante tampon fiziologice includ fosfați intracelulara organici și anorganici, precum și proteine, inclusiv hemoglobina. fosfați extracelulare și proteinele plasmatice în acest sens, joacă un rol mai puțin important. Oasele devin un tampon, absorbind extracelular HCO3-. La început au fost în schimbul H+ eliberare carbonat de Na (NaHCO3)3) Și K carbonat (KHCO3), iar atunci când mai acide de încărcare - carbonat de calciu (CaCO3) Și fosfat de Ca (CAPCO4). Prin urmare, acidemia pe termen lung, însoțită de o demineralizare a oaselor si osteoporoza.
Regulamentul pulmonară. Concentrația de CO2 strict reglementate volumul mareelor și frecvența respiratorie (ventilație minute). pH-ul redus percepută arterial și Chemoreceptors conduce la o creștere a volumului mareelor sau frecvența respirației. Acest lucru crește de expirație CO2 și, astfel, crește pH-ul sângelui. Spre deosebire de sistemele de tamponare chimice care reacționează rapid la schimbările de pH, reglarea pulmonară se efectuează într-o chestiune de minute sau ore. Eficiența sa variază de la de 50 la 75%, și nu este pe deplin normalizează pH.
Regulamentul renală. pH controlul Rinichii prin modificarea reabsorbția HCO3- și excreția H+- întârziere TVA3- echivalent cu numărul de ieșire H liber+.
reabsorbia TVA3- Aceasta are loc în principal în tubul proximal și colectare a conductelor. Celulele tubulare H2Pe disociază în H+ și hidroxid (OH-). Sub acțiunea anhidrazei carbonice OH- Se conecteaza cu CO2, formând un TVA3-, care este transmis înapoi la capilarele peritubulare, în timp ce H+ secretat in lumenul tubilor si nu este conectat la filtrat liber TVA3-, formând CO2 și H2Oh, care sunt, de asemenea, reabsorbtia subiect. Astfel, ionii sunt reabsorbite HCO3- - cei care s-au format din nou, nu și cele care au fost filtrate în glomeruli. Volumul redus efectiv de circulație (așa cum se întâmplă atunci când primesc diuretice) mărește reabsorbția HCO3-, întrucât creșterea nivelului hormonului paratiroidian ca răspuns la încărcarea acidă scade reabsorbtia acestui ion. Pentru a spori reabsorbția de HCO3- De asemenea, rezultă o creștere a PCO2, și reducerea Cl- (De obicei, datorită hipovolemiei) mărește reabsorbția Na+ TVA și educație3- în tubulii proximali.
H+ secretată activ în lumenul proximal și distal tubilor, care este conectat la urină compuși tampon - în principal, filtrat liber HPO4-2, creatininei, acidului uric și amoniac - excretată. Sistemul tampon de amoniu joacă un rol deosebit de important, deoarece alți compuși de tamponare filtrate la concentrații fixe și conținutul acestora pot fi reduse la încărcări mari de acid. Dimpotrivă, produsele de amoniac reglementate activ celule tubulare, ca răspuns la schimbările de încărcare de acid. Secreția de acid depinde în primul rând de pH-ul sângelui arterial, dar este, de asemenea, influențată de nivelurile K+, CI- și aldosteron. secreția H+ iar concentrația intracelulară de K+ sunt în relații reciproce: reducerea K+ Ea îmbunătățește secreția de H+ și, prin urmare, promovează dezvoltarea alcalozei metabolice.
Violarea echilibrului acido-bazic
Violarea acido-bazic echilibru modificări includ PCO2 nivelurile sanguine arteriale de HCO3- în ser și pH-ul seric.
Video: Oamenii de știință au descoperit un regulator al echilibrului acido-bazic
- Acidemia - pH zer <7,35.
- Alkalemiya - pH zer >7.45.
- Acidoza este cauzată de procese fiziologice, însoțite de acumularea de acizi sau baze pierdere.
- Alcaloză este cauzată de procese fiziologice, însoțite de acumularea sau pierderea acizilor de bază.
Modificările reale ale pH-ului depind de gradul de compensare a tulburărilor fiziologice ale echilibrului acido-bazic și angajarea în compensație o multitudine de procese.
clasificare
tulburări primare ale echilibrului acido-bazic au fost separate pe metabolice și respiratorii, în funcție de manifestările clinice și dacă modificările pH-ului sunt în principal asociate cu modificări ale nivelului de HCO3- sau PCO2 ser.
acidoză metabolică - concentrația HCO3- ser <24 мэкв/л.
motive:
- formarea crescută a acizilor;
- consumul de acid;
- au scăzut acizi excreția renală;
- Pierderea de HCO3- prin tractul gastro-intestinal sau rinichi
Alcaloza metabolică - concentrația HCO3- ser >24 meq / l.
motive:
- pierderea de acizi;
- HCO întârziere3-.
acidoza respiratorie - PCO2 >40 mm Hg. Art.
motivul:
- descrește în ventilație minut (gipovengilyatsiya).
alcaloza respiratorie - PCO2 <40 мм рт.ст.
motivul:
- crește în ventilație minut (hiperventilație).
Ori de câte ori există o încălcare a echilibrului acido-bazic, mecanisme compensatorii începe să se ajusteze pH-ul. Compensarea nu prevede normalizarea deplină a pH-ului și nu este niciodată excesivă.
Simptome și semne
Manifestările clinice ale tulburărilor pulmonare sau compensați ale echilibrului acido-bazic sunt limitate, în timp ce modificările decompensate severe au multe cardiovasculare, respiratorii, neurologice și consecințele metabolice.
diagnosticare
Determinarea CJS și electroliți în ser. Determinarea CJS permite obține pH-ul corect și PCO2. Nivelul de HCO3- calculat conform ecuației Henderson-Gasselbalha- pentru analiza chimică a serului poate fi determina în mod direct și mai precis acest nivel. Estimarea mai exactă a echilibrului acido-bazic, de regulă, poate fi obținută prin măsurarea pH-ului și PCO2 este sângele arterial. Cu toate acestea, cu insuficienta circulatorie sau resuscitare parametrilor de sânge venos cardiopulmonare reflecta mai fidel echilibrului acido-bazic în nivelul țesutului, și poate fi ghidat în evaluarea caracterului adecvat al terapiei de bicarbonat sau de ventilație.
Valorile PH caracterizează defectul primar (acidoză sau alcaloză), cu toate că aceste procese compensatorii transferate la valori normale. schimbări PCO2 reflectă componenta respiratorie și modificările HCO3- metabolice.
Cu toate acestea, pentru a decide dacă modificările SOP2 și HCO3- primară sau compensatorie și dacă există o încălcare mixtă poate fi necesară la unele tulburări mixte vychisleniya- de definiții ar putea fi inselator normal. Prin urmare, este necesar să se ia în considerare datele clinice în interpretarea rezultatelor de măsurare și de calcul (de exemplu, boli pulmonare cronice, insuficiență renală, un număr de medicamente de supradozaj).
Întotdeauna calcula cantitatea de decalaj anionic. Creșterea aproape întotdeauna indică o acidoză metabolică. decalaj anionic normal cu un HCO scăzut3- și o concentrație ridicată de Cl- ser indică non-anionic acidoză metabolică (hipercloremică). gap metabolică anion acidoza delta este calculată pentru a detecta metabolice alcaloză și Winter formula concomitentă utilizată pentru a determina dacă o compensare respirație adecvată sau reflectă doua încălcare a echilibrului acido-bazic.
 Reamberin pancreatită
Reamberin pancreatită Caracteristici ale echilibrului lichid-electrolit în furnizarea de asistență medicală de urgență
Caracteristici ale echilibrului lichid-electrolit în furnizarea de asistență medicală de urgență Primul ajutor pentru acidoza lactică
Primul ajutor pentru acidoza lactică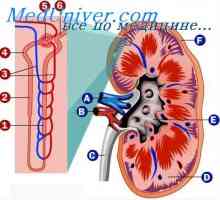 Fiziologia rinichi. Reglementarea echilibrului hidro-electrolitic
Fiziologia rinichi. Reglementarea echilibrului hidro-electrolitic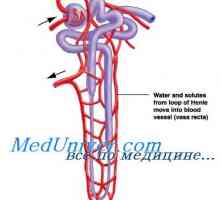 Influenta acidozei asupra schimbului de potasiu. Mecanisme de reglare concentrației de calciu
Influenta acidozei asupra schimbului de potasiu. Mecanisme de reglare concentrației de calciu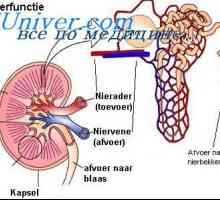 Echilibrul acido-bazic. Reglementarea concentrației ionilor de hidrogen
Echilibrul acido-bazic. Reglementarea concentrației ionilor de hidrogen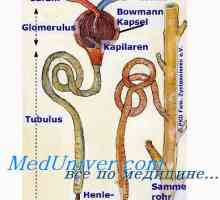 Menținerea concentrației ionilor de hidrogen. Funcția de sisteme tampon
Menținerea concentrației ionilor de hidrogen. Funcția de sisteme tampon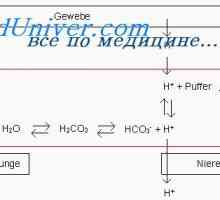 Ecuația Henderson-Hasselbach. rezervor tampon
Ecuația Henderson-Hasselbach. rezervor tampon Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph
Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph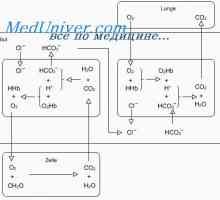 Sistem tampon Bicarbonat. Sistemul tampon fosfat
Sistem tampon Bicarbonat. Sistemul tampon fosfat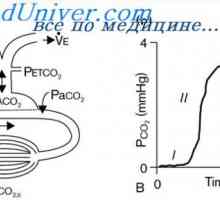 Capacitatea de tamponare a sistemului respirator. Participarea la reglementarea renală a…
Capacitatea de tamponare a sistemului respirator. Participarea la reglementarea renală a…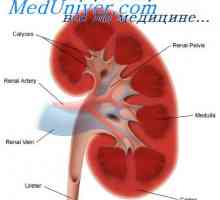 Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi
Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi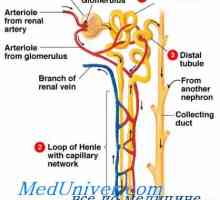 Dependența secreție de rinichi protoni. Mecanismele de secreție de protoni din tubii renali
Dependența secreție de rinichi protoni. Mecanismele de secreție de protoni din tubii renali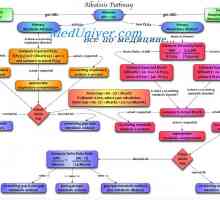 Cauzele alcaloză metabolică. Tratamentul acidozei și alcaloză
Cauzele alcaloză metabolică. Tratamentul acidozei și alcaloză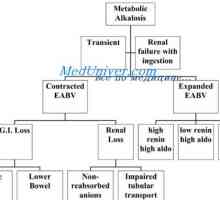 Evaluarea tulburărilor echilibrului acido-bazic. tulburări de echilibru de acid amestecat
Evaluarea tulburărilor echilibrului acido-bazic. tulburări de echilibru de acid amestecat Transportul de dioxid de carbon în sânge. Disocierea dioxidului de carbon
Transportul de dioxid de carbon în sânge. Disocierea dioxidului de carbon Renaștere lentă în perioada postanesthetic
Renaștere lentă în perioada postanesthetic Acidoza și alcaloza
Acidoza și alcaloza Metode de determinare a stării de echilibru acido-bazic
Metode de determinare a stării de echilibru acido-bazic Aspecte metodologice. Evaluarea de diagnosticare a sistemelor funcționale. Sistemul de organizare…
Aspecte metodologice. Evaluarea de diagnosticare a sistemelor funcționale. Sistemul de organizare… Dioxid de carbon. Transportul de dioxid de carbon.
Dioxid de carbon. Transportul de dioxid de carbon.
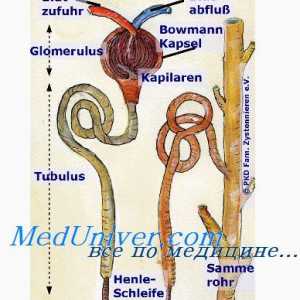 Menținerea concentrației ionilor de hidrogen. Funcția de sisteme tampon
Menținerea concentrației ionilor de hidrogen. Funcția de sisteme tampon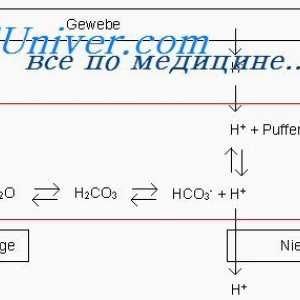 Ecuația Henderson-Hasselbach. rezervor tampon
Ecuația Henderson-Hasselbach. rezervor tampon Reamberin pancreatită
Reamberin pancreatită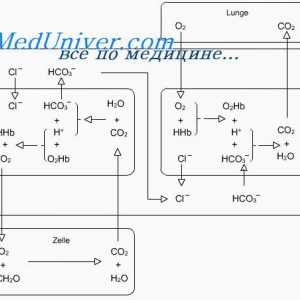 Sistem tampon Bicarbonat. Sistemul tampon fosfat
Sistem tampon Bicarbonat. Sistemul tampon fosfat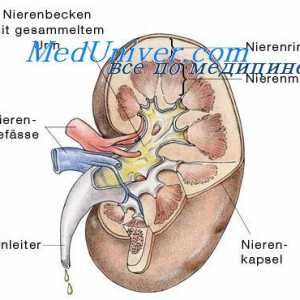 Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph
Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph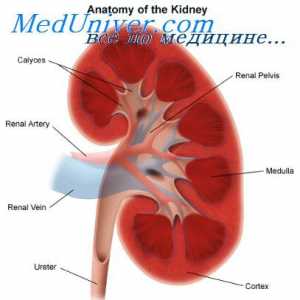 Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi
Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi