Menținerea concentrației ionilor de hidrogen. Funcția de sisteme tampon
Video: Configurarea stațiilor de bază dezinfecție Pool ePool.ru
acolo Trei sisteme principale, care au ca scop reglementarea conținutului H + ioni în mediu lichid, prevenind acidoză sau alcaloză: (1) sistemul de tamponare a fluidelor din organism pentru a reacționa imediat chimic cu acizi sau baze, prevenind modificarea conținutului de ioni H + - (2), sistemul respirație, centrul respirator care controlează eliminarea luminii CO2 (deci H2CO3) a zhidkosti- extracelular (3) rinichi, care sunt capabile să elibereze urinei acide sau alcaline, compensând astfel în măsură să dezvolte acidoză sau alcaloză.
când se schimbă conținutul sistemelor tampon de protoni pentru fracțiuni de secundă face ajustări pentru a atenua efectele unor astfel de intervenții. Sistemele tampon nu înlătură protonii și nu cresc conținutul lor în organism, ele se leagă H +, atâta timp cât restabilirea echilibrului acido-alcalin.
Al doilea "linie de apărare„Servește ca sistemul respirator, care, în câteva minute, este capabil de a deriva dintr-un organism de CO2 și, prin urmare, H2CO3.
Primele două „linie de apărare“ pentru a preveni dezvoltarea unor schimbări semnificative în conținutul de ioni H +, în timp ce mecanismele mai lente treilea sistem - excretorii - nu elimina conținut excesiv de acizi sau baze. Comparativ cu alte sisteme, rinichii sunt lent (câteva ore sau zile), dar eficacitatea lor în menținerea echilibrului acido-alcalin este mult mai mare.
tampon Se face referire la orice substanță capabilă de legare reversibil protoni. Schema generală de tampon de reacții este după cum urmează: Tampon + H <=> Н Буфер
În acest exemplu, liber protoni Acesta comunică cu compusul tampon, pentru a forma un acid slab (tampon H), unde protonul poate rămâne în formă legată, sau din nou disocia. Prin creșterea concentrației de ioni H +, reacția este deplasată spre dreapta, reducând în același timp - stânga. Prin acest mecanism, schimbări în conținutul ioni H + în low medii lichide.
Înțeles sisteme tampon pentru organism poate fi înțeleasă prin luarea în considerare faptul că, în ciuda formării într-o zi cantitate relativ mare de produse acide, concentrația de ioni H + în mediul lichid rămâne la un nivel scăzut. De exemplu, cu alimente sau ca urmare a unor procese metabolice forme zilnice Xia aproximativ 80 mEq de ioni H +, în timp ce o concentrație de numai aproximativ 0,00004 meq / l. În absența unor sisteme tampon sau absorbție a corpului în tractul gastrointestinal astfel cantitatea de produse acide ar trebui să conducă la modificări semnificative ale concentrației ionilor de H +.

Mecanismul de acțiune a sistemelor tampon în menținerea echilibrului acido-bazic poate fi ilustrat de cel mai puternic dintre ele - sistem tampon bicarbonat.
sistem tampon Bicarbonat Acesta constă dintr-o soluție apoasă care conține două componente: (1) un acid slab N2SO3- (2) sare de bicarbonat, de exemplu NaNSOz.
H2CO3 format în organism prin intermediul reacției de CO2 cu H2O: CO2 + H2O<=> н2со3
Această reacție fără enzimă anhidrazei carbonice este lentă, însoțită de formarea unor cantități mici de H2CO3. anhidrazei carbonice este prezentă în cantități considerabile în peretele alveolelor pulmonare, în care separarea CO2, precum și în celulele epiteliale ale tubilor renali, în care dioxidul de carbon reacționează cu apa pentru a forma H2CO3.
H2CO3 disociază slab, formând o mică cantitate de ioni H + și HCO3: H2CO3 <=> н+ + нсо3
A doua componentă a sistemului - bicarbonat de ioni - în fluidul extracelular apare predominant sub formă de bicarbonat de sodiu (NaHCC ^). El disociază aproape complet pentru a forma HCO3 și Na +: NaHC03 <=> Na+ + HCО3.
B sistem tampon, în general, bicarbonatul este după cum urmează: CO2 + H2O <=> н2со3 <=> н+ + нсо3.
H2CO3 disociază slab, astfel încât concentrația de ioni H + eliberat în soluție este extrem de mică.
Dacă adăugați pentru a amortiza un acid puternic, HK1 de exemplu, protoni, au primit cu acidul (CI1 -> H + + Cl-), se neutralizează HCO3: H + + HCO3 -> H2CO3 -> + H2O C02.
Ca rezultat, au format mai mult de H2CO3, care crește formarea de CO2 și H2O. Conform reacțiilor arătate, se observă că H + acid puternic reacționează cu HCI HCO3- formă H2CO3 slab acid care se descompune în dioxid de carbon și apă. CO2 în exces stimulează în mod semnificativ respiratia, promovarea eliberării de CO2 din fluidul extracelular.
Reacțiile observate în direcția opusă adăugarea la soluția tampon o bază puternică, cum ar fi hidroxidul de sodiu (NaOH): NaOH + H2CO3 -> H20 + NaHC03
În acest caz, ionul OH- reacționează cu H2CO3, contribuind la NPHS educație suplimentară ~. Astfel, baza slabă IaNSOz înlocuiește NaOH puternic. În același timp, se observă o scădere a concentrației soluție de H2CO3 (deoarece reacționează cu NaOH), care contribuie la reacția și sinteza de noi molecule de CO2 acid carbonic cu H2O: CO2 + H2O -> H2CO3 -> HCO3- + H +.
Ca urmare, planificat o tendință de a reduce nivelul de CO2 în plasmă, care la rândul său inhibă centrul respirator și reduce emisiile de CO2. Există un conținut crescut de ioni HCO3, compensat prin emisia de bicarbonat de rinichi.
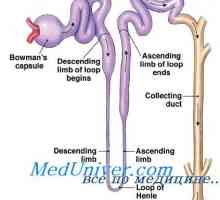 Celule de rinichi primare de secreție de potasiu. Factori care reglementează secreția de potasiu
Celule de rinichi primare de secreție de potasiu. Factori care reglementează secreția de potasiu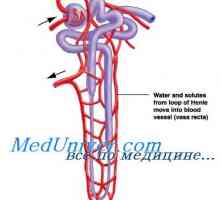 Influenta acidozei asupra schimbului de potasiu. Mecanisme de reglare concentrației de calciu
Influenta acidozei asupra schimbului de potasiu. Mecanisme de reglare concentrației de calciu Participarea la schimbul de magneziu rinichi. Reglarea volumului fluidului interstițial
Participarea la schimbul de magneziu rinichi. Reglarea volumului fluidului interstițial Echilibrul acido-bazic. Reglementarea concentrației ionilor de hidrogen
Echilibrul acido-bazic. Reglementarea concentrației ionilor de hidrogen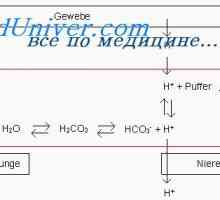 Ecuația Henderson-Hasselbach. rezervor tampon
Ecuația Henderson-Hasselbach. rezervor tampon Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph
Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph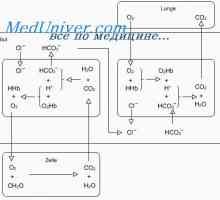 Sistem tampon Bicarbonat. Sistemul tampon fosfat
Sistem tampon Bicarbonat. Sistemul tampon fosfat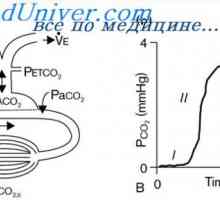 Capacitatea de tamponare a sistemului respirator. Participarea la reglementarea renală a…
Capacitatea de tamponare a sistemului respirator. Participarea la reglementarea renală a…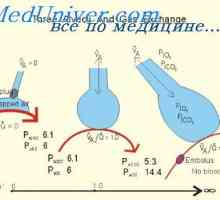 Influența ventilație alveolar asupra pH-ului. Efectul pH-ului asupra sistemului respirator
Influența ventilație alveolar asupra pH-ului. Efectul pH-ului asupra sistemului respirator Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi
Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi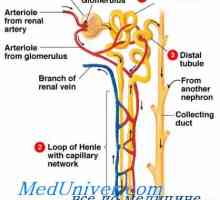 Dependența secreție de rinichi protoni. Mecanismele de secreție de protoni din tubii renali
Dependența secreție de rinichi protoni. Mecanismele de secreție de protoni din tubii renali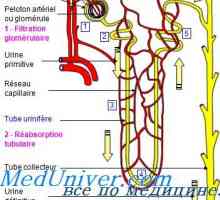 Corecție alcaloză rinichi. Mecanisme de corectare renale alcalozei
Corecție alcaloză rinichi. Mecanisme de corectare renale alcalozei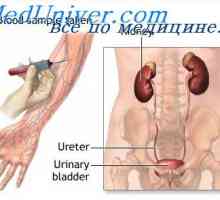 Mecanismul de formare a noilor ioni bicarbonat. Sistemul renal tampon fosfat
Mecanismul de formare a noilor ioni bicarbonat. Sistemul renal tampon fosfat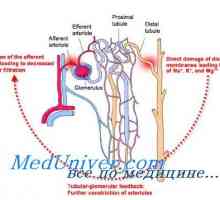 Corectarea acidozei rinichilor. Mecanismele de corecție acidoză renală
Corectarea acidozei rinichilor. Mecanismele de corecție acidoză renală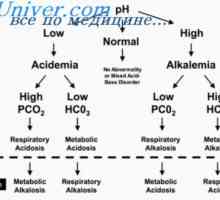 Sistemul tampon de amoniu. Cuantificarea acizi și baze de alocare
Sistemul tampon de amoniu. Cuantificarea acizi și baze de alocare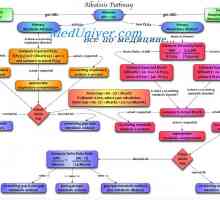 Cauzele alcaloză metabolică. Tratamentul acidozei și alcaloză
Cauzele alcaloză metabolică. Tratamentul acidozei și alcaloză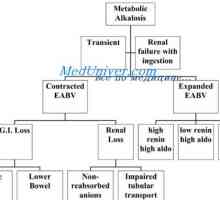 Evaluarea tulburărilor echilibrului acido-bazic. tulburări de echilibru de acid amestecat
Evaluarea tulburărilor echilibrului acido-bazic. tulburări de echilibru de acid amestecat Hidroelectrolitice tulburări de corecție și tulburări de durere la șoc
Hidroelectrolitice tulburări de corecție și tulburări de durere la șoc Acidoza și alcaloza
Acidoza și alcaloza Metode de determinare a stării de echilibru acido-bazic
Metode de determinare a stării de echilibru acido-bazic Aspecte metodologice. Evaluarea de diagnosticare a sistemelor funcționale. Sistemul de organizare…
Aspecte metodologice. Evaluarea de diagnosticare a sistemelor funcționale. Sistemul de organizare…
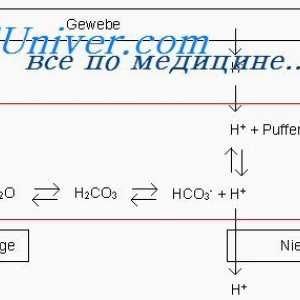 Ecuația Henderson-Hasselbach. rezervor tampon
Ecuația Henderson-Hasselbach. rezervor tampon Regulament și tulburări ale echilibrului acido-bazic
Regulament și tulburări ale echilibrului acido-bazic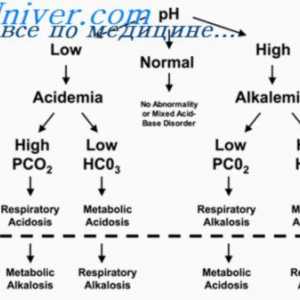 Sistemul tampon de amoniu. Cuantificarea acizi și baze de alocare
Sistemul tampon de amoniu. Cuantificarea acizi și baze de alocare Mecanismul de formare a noilor ioni bicarbonat. Sistemul renal tampon fosfat
Mecanismul de formare a noilor ioni bicarbonat. Sistemul renal tampon fosfat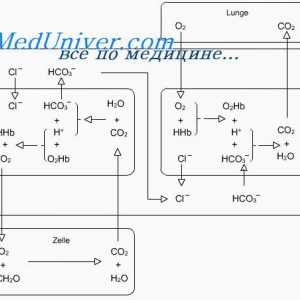 Sistem tampon Bicarbonat. Sistemul tampon fosfat
Sistem tampon Bicarbonat. Sistemul tampon fosfat Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph
Acizi și baze tari și slabe. Concentrația ionilor de hidrogen și ph Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi
Rinichi Neutralizarea protoni. Mecanismul principal al secreției de hidrogen activ ioni de rinichi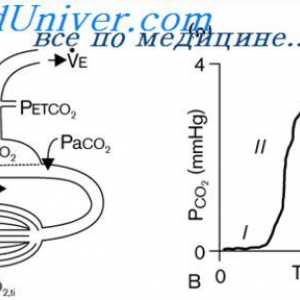 Capacitatea de tamponare a sistemului respirator. Participarea la reglementarea renală a…
Capacitatea de tamponare a sistemului respirator. Participarea la reglementarea renală a…