Afinitatea hemoglobinei pentru oxigen. Modificarea afinitatea hemoglobinei pentru oxigen. efect Bohr.
Afinitatea hemoglobinei pentru oxigen. Modificarea afinitatea hemoglobinei pentru oxigen. efect Bohr
molecula de hemoglobina Ea poate exista în două forme - încordat și relaxat. formă de hemoglobină destins are capacitatea de a suge de oxigen este de 70 de ori mai rapid decât tensionată. Schimbarea fracțiunilor tensionate și formele relaxate într-o cantitate totală de hemoglobină din sânge determină curba de disociere formă oxihemoglobină în formă de S, și în consecință, așa-numita afinitatea hemoglobinei pentru oxigen. În cazul în care probabilitatea de tranziție de la tensionate la forme relaxate ale hemoglobinei mai mult, crescând afinitatea hemoglobinei pentru oxigen, și vice-versa. Probabilitatea de formarea numitei fracțiuni de hemoglobină variază în sus sau în jos, sub influența mai multor factori.
Factorul principal - legarea de oxigen cu molecula fuppoy hemoglobina geminovoy. Cea mai mare hemoglobină geminovyh fupp leagă oxigenul în celulele roșii din sânge, cu atât mai ușor devine tranziție molecula de hemoglobina la forma relaxat și cu cât afinitatea pentru oxigen. Prin urmare, atunci când un P02 scăzut, ceea ce este cazul în țesuturile active metabolic, hemoglobină afinitate de oxigen de mai jos și la P02 ridicată - de mai sus. Odată ce hemoglobina captează oxigenul mărește afinitatea pentru oxigen pentru molecula de hemoglobina devine saturat la legarea la patru molecule de oxigen.

Când eritrocite care conțin hemoglobină, ajung țesuturi, apoi oxigen dispersează în eritrocite de celule. În mușchi, intră în tipul de depozit de oxigen - în molecula mioglobinei din care oxigenul este utilizat în oxidarea biologică a mușchilor.
difuzia oxigenului din hemoglobinei eritrocitare în țesutul din cauza low-P02 în țesuturi - 35 mm Hg. Art. In interiorul tensiunea oxigenului tisular celulei necesare pentru a mentine metabolismul normal, este încă în cantitate mai mică - mai mică de 1 kPa. De aceea, prin difuzia oxigenului din capilare ajunge la celulele active metabolic. Unele țesături sunt adaptate la concentrații scăzute de P02 în capilarele sanguine, care este compensată de o mare densitate de capilare per unitatea de volum de țesut. De exemplu, în mușchii scheletici și cardiace P02 în capilare pot scădea extrem de rapid in timpul contractiei. In celulele musculare a conținut o proteină mioglobinei, care are o afinitate mai mare pentru oxigen decat hemoglobina. Mioglobina oxigenat intens și contribuie la difuzarea acesteia din sânge la mușchiul scheletic și cardiac, în cazul în care acesta determină procesele de oxidare biologică. Aceste țesuturi sunt capabile să extragă până la 70% oxigen din sange care trece prin ele, datorită reducerii afinității hemoglobinei pentru oxigen sub influența temperaturii țesuturilor și a pH-ului.
Efectul pH-ului și a temperaturii asupra afinitatea hemoglobinei pentru oxigen. Moleculele Hemoglobina capabile să reacționeze cu ionii de hidrogen, ca rezultat al acestei reacții, o reducere a afinității hemoglobinei pentru oxigen. La saturarea hemoglobinei cu pH scăzut mai puțin de 100% reduce legarea oxigenului la hemoglobină - oxihemoglobină curba de disociere deplasată spre dreapta de-a lungul axei x. Această schimbare a proprietăților hemoglobinei sub influența ionilor de hidrogen este numit efectul Bohr. Țesuturi produc activi metabolic acizi cum ar fi lactic și C02. Dacă pH-ul plasmei sanguine scade 7.4-7.2 normală, care are loc atunci când reducerea mușchi, concentrația de oxigen în aceasta va crește datorită efectului Bohr. De exemplu, la un pH constant de 7,4 dat de sânge la aproximativ 45% oxigen, adică. E. Saturația în oxigen a hemoglobinei a fost redus la 55%. Cu toate acestea, atunci când pH-ul este scăzut la 7,2, deplasările curbei de disociere a lungul axei x spre dreapta. Ca rezultat, saturația hemoglobinei cu oxigen scade la 40%, punct de topire. Țesut E. Sângele poate fi administrat în până la 60% oxigen, care este de 1 / s este mai mare decât la un pH constant.

Țesut activ metabolic crește producția de energie termică. Temperatura tisulară crescută în timpul efortului fizic modifică raportul fracțiunilor de hemoglobină în celulele roșii din sânge și determină deplasarea curbei de disociere oxihemoglobină la dreapta de-a lungul axei x. Ca urmare, o cantitate mai mare de oxigen este eliberată din hemoglobina eritrocitelor și intră în țesutul.
Efectul 2,3-difosfogliceratului (2,3-DPG) în afinitatea hemoglobinei pentru oxigen. În anumite condiții fiziologice, de exemplu prin scăderea P02 în sânge sub normal (hipoxie), datorită expunerii umane la mare altitudine deasupra nivelului mării, alimentarea cu oxigen devine insuficient. Când hipoxie poate scădea afinitatea hemoglobinei pentru conținutul de oxigen din cauza unei creșteri a hematiilor 2,3-DPG. Spre deosebire de efectul Bohr, scaderea afinitatea hemoglobinei pentru oxigen sub influența 2,3-DPG nu este reversibilă în capilarele pulmonare. Cu toate acestea, în cazul conducerii sângelui prin capilarele efectelor pulmonare ale 2,3-DPG pentru a reduce formarea de oxihemoglobină în eritrocite (partea plată a curbei oxihemoglobină de disociere) este exprimată într-o măsură mai mică decât eliberarea de oxigen sub influența 2,3-DPG în țesuturi (porțiunea înclinată a curbei) care cauzeaza normal de aprovizionare cu oxigen la tesuturi.
 Poate fi hemoglobina scăzută și creșterea vitezei de sedimentare a hematiilor de hemoroizi?
Poate fi hemoglobina scăzută și creșterea vitezei de sedimentare a hematiilor de hemoroizi?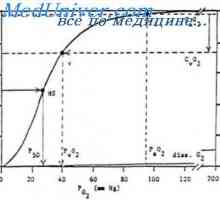 Deficit de piruvat kinază a fătului. hemoglobinopatii
Deficit de piruvat kinază a fătului. hemoglobinopatii Pulsoximetria la nou-născuți. mărturie
Pulsoximetria la nou-născuți. mărturie Primul ajutor pentru cianoză. Diagnosticul diferențial al cianoza
Primul ajutor pentru cianoză. Diagnosticul diferențial al cianoza Primul ajutor pentru stenoza central și periferic
Primul ajutor pentru stenoza central și periferic Permeabilitatea placentei. Difuzia oxigenului prin placenta
Permeabilitatea placentei. Difuzia oxigenului prin placenta Reglementarea homeostaziei. Mecanisme de reglementare ale corpului
Reglementarea homeostaziei. Mecanisme de reglementare ale corpului Eritrocite. Structura și compoziția celulelor roșii din sânge
Eritrocite. Structura și compoziția celulelor roșii din sânge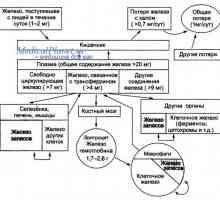 Legarea hemoglobinei cu oxigen. metabolismul fierului
Legarea hemoglobinei cu oxigen. metabolismul fierului Anemia pernicioasă. formarea hemoglobinei
Anemia pernicioasă. formarea hemoglobinei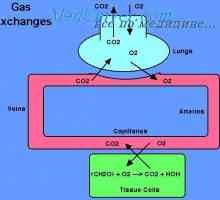 Hemoglobina. Rolul hemoglobinei în transportul de oxigen
Hemoglobina. Rolul hemoglobinei în transportul de oxigen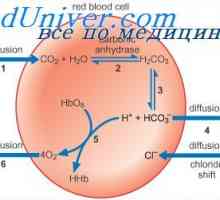 Factorul de utilizare a oxigenului. Conservarea oxigenului în țesuturile constanță
Factorul de utilizare a oxigenului. Conservarea oxigenului în țesuturile constanță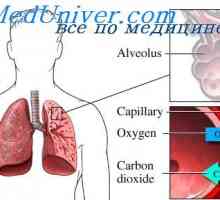 Transportul oxigenului în formă dizolvată. deplasarea oxigenului
Transportul oxigenului în formă dizolvată. deplasarea oxigenului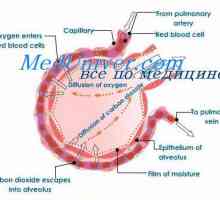 Efect Haldane. Modificări în aciditate sânge
Efect Haldane. Modificări în aciditate sânge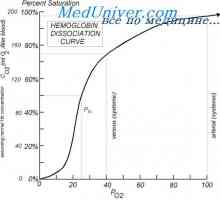 Disocierea de oxihemoglobină și dependența acesteia. efect Bohr
Disocierea de oxihemoglobină și dependența acesteia. efect Bohr Azot narcoză. toxicitatea oxigenului
Azot narcoză. toxicitatea oxigenului Cianoză și cauzele sale. hipercapnia
Cianoză și cauzele sale. hipercapnia Nivelurile scăzute ale hemoglobinei provoacă anemie
Nivelurile scăzute ale hemoglobinei provoacă anemie Privire de ansamblu asupra cianoză
Privire de ansamblu asupra cianoză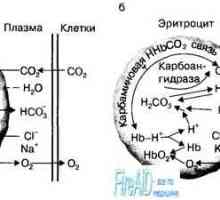 Rolul eritrocitelor în transportul de dioxid de carbon. Efectul Holden.
Rolul eritrocitelor în transportul de dioxid de carbon. Efectul Holden. Transportul gazelor din sânge. transportul oxigenului. Capacitatea de oxigen a hemoglobinei.
Transportul gazelor din sânge. transportul oxigenului. Capacitatea de oxigen a hemoglobinei.
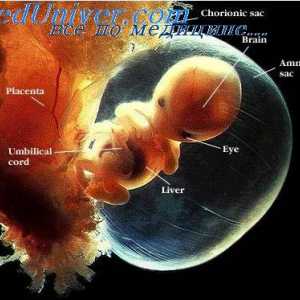 Permeabilitatea placentei. Difuzia oxigenului prin placenta
Permeabilitatea placentei. Difuzia oxigenului prin placenta Transportul gazelor din sânge. transportul oxigenului. Capacitatea de oxigen a hemoglobinei.
Transportul gazelor din sânge. transportul oxigenului. Capacitatea de oxigen a hemoglobinei.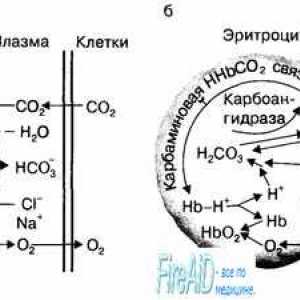 Rolul eritrocitelor în transportul de dioxid de carbon. Efectul Holden.
Rolul eritrocitelor în transportul de dioxid de carbon. Efectul Holden. Anemia pernicioasă. formarea hemoglobinei
Anemia pernicioasă. formarea hemoglobinei Poate fi hemoglobina scăzută și creșterea vitezei de sedimentare a hematiilor de hemoroizi?
Poate fi hemoglobina scăzută și creșterea vitezei de sedimentare a hematiilor de hemoroizi? Hemoglobina (hemoglobinopatii)
Hemoglobina (hemoglobinopatii)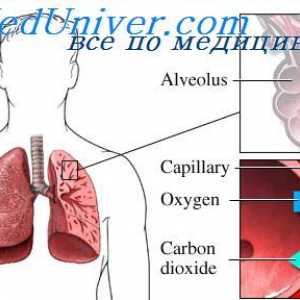 Transportul oxigenului în formă dizolvată. deplasarea oxigenului
Transportul oxigenului în formă dizolvată. deplasarea oxigenului Eritrocite. Structura și compoziția celulelor roșii din sânge
Eritrocite. Structura și compoziția celulelor roșii din sânge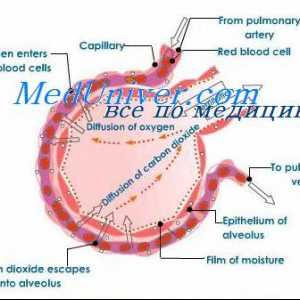 Efect Haldane. Modificări în aciditate sânge
Efect Haldane. Modificări în aciditate sânge