Principalele componente chimice ale organismelor vii
Video: Compoziția chimică a celulelor
Acest articol se va da un rezumat al structurii și funcțiilor principalelor componente chimice ale organismelor vii necesare pentru înțelegerea principalelor beneficii ale materialului. Mai detaliat în această secțiune materialul este considerat în curs de chimie organică și biochimie.rol fundamental în structura și activitatea organismelor joacă proteine (proteine) - substanțe macromoleculare organice azotate, construite dintr-un-aminoacizi. Cele mai multe dintre funcțiile biologice ale proteinelor se realizează sau cu participarea directă a acestora. Proteinele - componenta de bază și necesară a tuturor organismelor. În natură, există aproximativ 10-10 octombrie 12 proteine diferite responsabile pentru viața de mai mult de 2 milioane de specii de organisme de toate gradele de dificultate - de la virusuri la om.
Proteinele cu greutate moleculară în intervalul 10000-1000000. În ciuda diferențelor de structură și funcții, compoziția elementară a proteinelor variază ușor. Proteinele conțin (% la materia uscată): 50 ... 55% carbon, 21. ..23% oxigen, 15 ... 17% azot, 6 ... 7% hidrogen, 0,3 ... 2 5% sulf. Compoziția proteinelor individuale se gasesc ca fosfor, iod, fier, cupru, seleniu și alte macro și micronutrienți în diverse, adesea foarte mici, cantitati.
Structura proteinelor organismelor vii și include 19 aminoacizi în care grupările amino și carboxil sunt atașate la același atom de carbon și prolina acidului imino. Toți acești acizi sunt numite proteinogenici (adesea prolină nu este izolat și includ gruparea amino proteinogenici douăzeci). Dăm numele de aminoacizi proteinogenici și latin litere și cu o literă denumirea lor: alanină (Ala, A), arginină (Arg, R), acid aspartic (Asp, D), asparagină (Asn, N), valină * (Val, V), histidină (His, H), glicină (Gly, G), acid glutamic (Glu, E), glutamină (Gin, Q), izoleucina * (He, I), leucină * (Leu, L), lizină * (Lys, K ), metionină * (Met, M) prolină (Pro, P), serină (Ser, S), tirozină (Tyr, Y), treonina * (Thr, T), triptofan * (Trp, W), fenilalanină * ( Phe, F), cisteină (Cys, C) (simbolul * în respectivele secvențe sunt așa numitele aminoacizi esențiali care sintetizați numai despre plante și nu sintetizate în corpul uman). În cazul în care cantitatea acestor aminoacizi în dieta este insuficientă, dezvoltarea normală și funcționarea organismului uman este perturbată.
Aminoacizii - un compus heterofuncționale. Molecula de aminoacizi conține o pluralitate de grupări funcționale: grupare amino -NH2, o grupare carboxil -COOH și radicalii -R, având o structură diferită:

În soluție apoasă, la valori de pH apropiate de aminoacizi neutri exista ca amfioni NH3 + CHRCOO-.
Toți aminoacizii, cu excepția cel mai simplu de acid aminoacetic (glicină) au un atom de carbon asimetric - C * - și pot exista ca doi izomeri optici (enantiomeri): L- și D-. Compoziția tuturor proteinelor investigate include acum numai seria L aminoacizi, în care, atunci când este privit atom asimetric de la un atom de H, o grupare -NH3 +, -COO" și -R radical aranjate în sens orar. Proteinele simple (proteine) constau numai din resturile belkov- proteine complexe (proteid) includ proteina (apoproteina) și non-proteină (gruparea prostetică) părți.
Fiecare proteină are propriul aranjament secvență de acid, inerent amino. resturile de aminoacizi legate prin legături peptidice sau amidice (-CO-NH-) o legătură între grupările a-amino și o carboxil. În funcție de numărul de resturi de acid a-amino implicate în construcția peptidei, oligopeptide distinge (tri la decapeptide) și polipeptide. Denumirile peptidelor formează sufixul -il corespunzător unui amino acizi nume și aminoacizi implicate în formarea legăturii peptidice datorită grupelor carboxil, a fost preparat. La finalul acestui grup amino cu un hidrogen liber este notat cu H, iar capătul cu un grup liber carboxil - un simbol OH, de exemplu: H-Val-Ser-OH - valilserin.
Proteinele ca structură biologică semnificativă poate fi fie o polipeptidă unică sau mai multe polipeptide care constituie rezultat interacțiuni necovalente singur complex.
Proprietate exclusivă de proteine - structuri de auto-organizare, adică, capacitatea de a produce în mod spontan o anumită structură spațială inerentă numai această proteină. Sa constatat că toate proteinele sunt construite pe același principiu și au patru niveluri de organizare: primare, secundare, terțiare, iar unele dintre ele - și structura cuaternare.
Secvența de resturi de aminoacizi în lanțul polipeptidic al compusului este numit structura primară a proteinei (fig. 1). Acesta este un lanț liniar de aminoacizi (polipeptide) aranjate în secvență cu rotație determinate genetic clare și interconectate prin legături peptidice.

Fig. 1. Structura primară a proteinei
Până în prezent, secvențele de aminoacizi la mai multe mii de proteine diferite. Înregistrarea structurii proteinelor sub forma unor formule structurale detaliate greoaie și nu intuitiv. Prin urmare, utilizarea prescurtare - trei litere sau a unui singur cod. Când înregistrați în secvența de aminoacizi a lanțurilor polipeptidice sau oligopeptide folosind simboluri prescurtate asumate dacă nu se specifică în mod expres că gruparea a-amino de pe partea stângă și o grupă carboxil - pe dreapta.
Structura secundară menționată ca conformație, care formează un lanț polipeptidic. Structura secundară are cele mai multe proteine, cu toate acestea, nu sunt întotdeauna peste tot lanțul polipeptidic. Datorită legăturilor de hidrogen dintre grupurile de peptide și - resturi de aminoacizi dobândi o elicoidale lanțuri polipeptidice de formă (a - structura). legături de hidrogen poate furniza un compus și lanțuri (alungite) polipeptidici adiacente pentru a forma alte tipuri de structuri secundare - o structură (structura din foaia pliată, stratul pliat).
Informații despre alternanța resturilor de aminoacizi din catena polipeptidică (structura primară) și prezența unei molecule de proteină spiralized, stratificate și fragmente dezordonate ale acestora (structura secundară) nu oferă o imagine completă a întregii cantități de volum, nici formă, nici măcar pe pozițiile relative ale secțiunilor de lanț polipeptidic în raport unul cu altul. Aceste caracteristici ale structurii proteinei stabili atunci când se studiază structura sa terțiară, care se referă la o locație generală în spațiu a moleculelor unuia sau mai multor lanțuri polipeptidice legate prin legături necovalente.
Printre legăturile care dețin structura terțiară, trebuie remarcat:
a) punți disulfidice (-S-S-) între două resturi de cisteină;
b) o punte de ester (între carboxil și hidroxil grupe);
c) o punte de sare (între gruparea carboxil și gruparea amino);
legături g) hidrogen între grupările CO- și -NH.
Structura terțiară explică specificitatea moleculei de proteină, activitatea sa biologică.
Majoritatea organizării spațiale a structurii terțiare de proteine se termină, dar pentru unele proteine cu o greutate moleculară mai mare de 50 100 000 ... construit din mai multe lanțuri de polipeptide este structura caracteristică cuaternare. Esența acestei structuri este de a combina mai multe lanțuri polipeptidice cu structura sa primară, secundară și terțiară într-un singur complex
Distrugerea legăturilor care stabilizează cuaternar, structura terțiară și secundară, conducând la dezorientarea și configurația moleculei de proteină, agregarea, modificarea proprietăților fizice (solubilitate, vâscozitate) și activitatea chimică, reducerea sau pierderea totală a funcției biologice este numită proteină Denaturarea. Structura primară, și, prin urmare, compoziția chimică a proteinei nu este schimbat.
SV Makarov, TE Nikiforov, NA Kozlov
Distribuiți pe rețelele sociale:
înrudit
 Biochimie Sangele pancreasului cu pancreatită
Biochimie Sangele pancreasului cu pancreatită Structura gastrinei. Fiziologia secretiei pancreatice
Structura gastrinei. Fiziologia secretiei pancreatice Stocarea aminoacizilor. Fiziologia proteinelor plasmatice din sânge
Stocarea aminoacizilor. Fiziologia proteinelor plasmatice din sânge Descompunerea proteinelor. Fiziologia defalcare Regulamentul proteinelor
Descompunerea proteinelor. Fiziologia defalcare Regulamentul proteinelor Fiziologia nutriției. dietă
Fiziologia nutriției. dietă Schimbul de proteine in ficat. Rolul ficatului în sinteza proteinelor și a distrugerii
Schimbul de proteine in ficat. Rolul ficatului în sinteza proteinelor și a distrugerii Mecanismele de actiune ale anticorpilor. activarea sistemului Complement de anticorpi
Mecanismele de actiune ale anticorpilor. activarea sistemului Complement de anticorpi Etapele sintezei proteinelor în organism
Etapele sintezei proteinelor în organism Mecanisme degradare și catabolismul proteinelor într-un organism
Mecanisme degradare și catabolismul proteinelor într-un organism Cererea de proteine si aminoacizi la nou-născuții prematuri foarte
Cererea de proteine si aminoacizi la nou-născuții prematuri foarte Proteinele din alimente
Proteinele din alimente Importanța fiziologică a componentelor majore ale produselor alimentare
Importanța fiziologică a componentelor majore ale produselor alimentare Ingrediente alimentare de bază în lupta împotriva obezității
Ingrediente alimentare de bază în lupta împotriva obezității Proteine: ce face și de ce este nevoie, în cazul în care este o mulțime de proteine și de…
Proteine: ce face și de ce este nevoie, în cazul în care este o mulțime de proteine și de… Principalele componente chimice ale organismelor vii. diverși factori
Principalele componente chimice ale organismelor vii. diverși factori Schema tipică și principalele producții biotehnologice
Schema tipică și principalele producții biotehnologice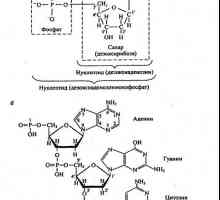 Principalele componente chimice ale organismelor vii. lipide
Principalele componente chimice ale organismelor vii. lipide CeRe (serebrolysinum) *. Eliberat de proteine substanta creierului hidrolizată. Acesta conține…
CeRe (serebrolysinum) *. Eliberat de proteine substanta creierului hidrolizată. Acesta conține… Analiza urinei în loc de sânge
Analiza urinei în loc de sânge Biologii au învățat cum de a sintetiza proteine de orice structură dorită
Biologii au învățat cum de a sintetiza proteine de orice structură dorită Ce este citoscheletului?
Ce este citoscheletului?
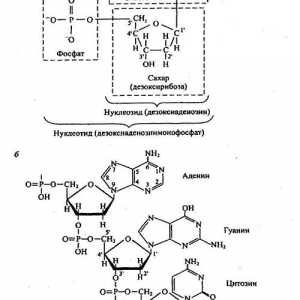 Principalele componente chimice ale organismelor vii. lipide
Principalele componente chimice ale organismelor vii. lipide Proteinele din alimente
Proteinele din alimente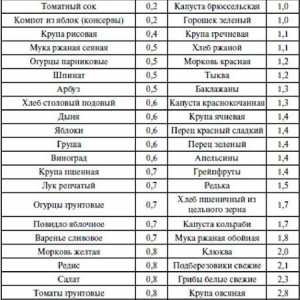 Ingrediente alimentare de bază în lupta împotriva obezității
Ingrediente alimentare de bază în lupta împotriva obezității Cererea de proteine si aminoacizi la nou-născuții prematuri foarte
Cererea de proteine si aminoacizi la nou-născuții prematuri foarte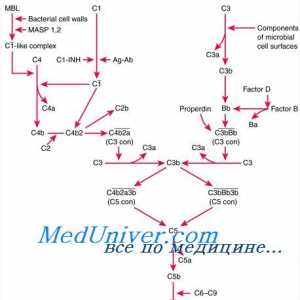 Mecanismele de actiune ale anticorpilor. activarea sistemului Complement de anticorpi
Mecanismele de actiune ale anticorpilor. activarea sistemului Complement de anticorpi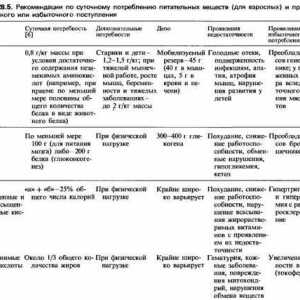 Mecanisme degradare și catabolismul proteinelor într-un organism
Mecanisme degradare și catabolismul proteinelor într-un organism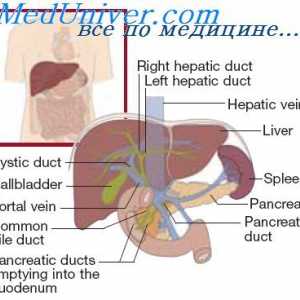 Schimbul de proteine in ficat. Rolul ficatului în sinteza proteinelor și a distrugerii
Schimbul de proteine in ficat. Rolul ficatului în sinteza proteinelor și a distrugerii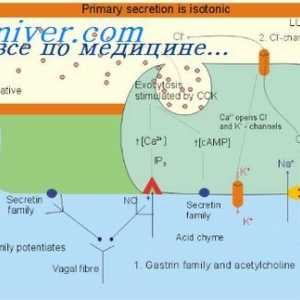 Structura gastrinei. Fiziologia secretiei pancreatice
Structura gastrinei. Fiziologia secretiei pancreatice Stocarea aminoacizilor. Fiziologia proteinelor plasmatice din sânge
Stocarea aminoacizilor. Fiziologia proteinelor plasmatice din sânge