Ubiquitin-proteazomal defalcare de proteine cale
Cele mai multe (80-90%) defalcare de proteine intracelulare efectuat calea ubiquitin-proteazom. Calea de ubiquitin-proteazom este prezent în nucleu și citoplasmă celulelor eucariote și joacă un rol important în descompunerea proteinelor normale și anormale. Aceasta cale este responsabilă pentru degradarea controlată a multor proteine, inclusiv cele necesare pentru a controla creșterea și proliferarea celulară, diferențierea celulară, răspunsurile imune si inflamatorii, apoptoza și adaptare metabolică.
Calea de ubiquitin-proteazom De asemenea, exercită funcția „economică“ în principal circulației proteinelor și eliminarea anormală proteine cu codificarea greșită, Misfolded localizate în zone non-core, deteriorate sau altfel scoasă din funcțiune. Calea ubiquitină-proteazom joacă un rol critic în controlul masei musculare, iar activitatea sa este îmbunătățită în cașexie. Această cale joacă, de asemenea, un rol important în refacerea musculara si remodelare.
Calea de ubiquitin-proteazom Acesta poate fi privit ca o succesiune de trei procese:
(1) recunoașterea substratului proteic la descompunere;
(2) legarea covalentă a lanțurilor poliubiquitinei ca o etichetă de proteine pentru degradare;
(3) proteoliza 2500 complex de proteine kD, numita 26S proteazomali.
de recunoaștere a proteinei, destinate descompunerii în mod tipic se efectuează:
(1) în conformitate cu unele modificări structurale ale proteinei, inclusiv efectele asupra unei secvențe de aminoacizi specifice, care este ascuns în mod normal modificările post-translaționale cum ar fi fosforilarea sau hidroxilare;
(2) pentru aderarea sau eliberarea liganzii săi;
(3) interacțiunea cu o proteină adaptor sau chaperon (de exemplu, proteine de export misfolded prin chaperones în citosolul EPR);
(4) Daunele specifice care apar în proteine prin oxidare sau nitrosylation.
În plus, prezența specifică "destabilizator„Porțiune Reziduurile iV-end a peptidei marca proiectată pentru clivaj (adică, cu un timp de înjumătățire scurt). Cu toate acestea, trebuie remarcat faptul că, înainte de a fi supus divizării, nu toate proteinele produse tag-ul ubiquitin.
In contrast, unele proteine sunt clivaj prin 20S proteazom majore. Scopul acestui model este de divizare neclar, dar se pare să se întâmple cu proteine având în mod clar regiunile nestructurate, oferind o mai mare instabilitate a proteinei.

Prima reacție - activarea ubiquitin E1 (enzimă ubikvitinaktiviruyuschim) și apoi livrate la ubiquitina E2 (ubikvitinprisoedinya yuschemu-enzimă).
A doua reacție - formarea unui complex cu E2, EZ (ubiquitina leagă enzimă) și substrat.
A treia reacție a - transferul de substrat ubiquitin lizină (-AM), substratul pentru a marca lanțul poliubiquitină. Ca rezultat, a patra etapă se separă de substratul poliubiquitină E3.
În final, substratul proteazomală mod ATP se deruleze dependentă de activitatea separă ubikvitingidralazy cu lanț ubiquitin și introduce proteina desfăcută în camera proteazom sunt porțiuni unde activitatea proteazei. Moleculele ubiquitin este reciclat, în timp ce peptidele rezultate sunt descompuse în aminoacizi și utilizat din nou pentru sinteza de proteine noi.
Ub - ubiquitină.
După ce proteina a fost identificată ca fiind substrat la degradare, aceasta este prevăzută cu un ubiquitin etichetat covalent. Ubiquitin - proteină prezentă în toate tipurile de celule și constă din resturile 76 aminoacizi incluzând o glicină C-terminală și rest lizină la poziția 48. Ubiquitin este legat covalent la proteina destinată degradării într-o serie de trei reacții catalizate de enzime cunoscute sub numele E1 (enzimă ubikvitinaktiviruyuschy), E2 (enzima ubikvitinprisoedinyayuschy) și E3 (enzimă ubikvitinsvyazyvayuschy).
acolo Două izoforme E1, Mai multe izoforme ale E2 și E3 este un număr foarte mare de enzime, care sa permita substraturi specifice ale multor țesuturi și reglementarea acestui proces.
prima moleculă ubiquitinei activate prin legarea la reacția dependentă de ATP E1, și apoi transferat la ubiquitina fragment E2. Și E1 și E2 sunt situsurile active ale resturilor de cisteină care formează tioesteri cu restul de glicină C-terminal al ubiquitin. În cele din urmă, ubiquitin alăturat E2 este transmis în mod direct sau prin reziduuri interior E3 lizilovomu pe substratul proteic.
E3 joacă un rol important în recunoașterea substrat proteic pentru clivaj și în reglarea complexului substrat formarea E2 / E3. Într-un mod similar cu alte molecule ubiquitin sunt atașate la un substrat având o moleculă ubiquitin atașată, formând legături isopeptide între reziduul de glicină C-terminal al moleculei ubiquitin și lizina situat la poziția 48, înainte de molecula ubiquitin adăugat.
necesar lanț cel puțin patru molecule de ubiquitin la proteine mai multe molecule marcate ubiquitin au fost recunoscute cu ușurință și sunt direcționate către 26S proteazomul clivaj. Recent, un studiu a fost de legare domenii de activitate și ubiquitin. Foarte important, procesul ubiquitination este reversibil, cu prezența procesului care are loc deconectarea clasei de cistein proteaze numite enzime deubikvitiniruyuschimi.
activitate enzimă deubikvitiniruyuschego Este de a elimina legarea de ubiquitin, procesarea precursorilor ubiquitin, care leagă lanțurile ubiquitină și refolosirii ubiquitin. Aceste procese sunt responsabile pentru reglementarea mai multor căi de semnalizare, care sunt importante pentru procesul de dezvoltare, inclusiv creșterea și diferențierea celulară.
reală degradarea proteinelor ubiquitinated are loc în camera interioară a proteazomului, dar moleculele de ubiguitină desprins mai întâi, astfel încât acestea să poată fi reutilizate, proteazomul 26S este mare, constând din mai multe subunități ale complexului, care include 20S subunitatea ca nucleu proteolitică cu 19S complexe de reglementare atașate la unul sau la ambele capete. subunitățile de reglementare sunt implicate în recunoașterea proteinelor marcate, îndepărtarea tag-ul ubiquitin, precum si procesele ATP-dependente de desfășurare a proteinei și nucleul său proteolitic într-o direcție având o formă de tunel.
proteolitice complex 20S este o structură de tip cilindru format din patru stivuite una peste celelalte structuri inelare (ABBA), fiecare dintre care este format din șapte subunități. Cavitatea centrală a structurii catalitice cuprinde un total de șase porțiuni proteolitice formate trei subunități catalitice distincte fiecare b-inel. Acestea se referă la subunități catalitice-TV terminale gidralazam treonina ca acte treonină iV-terminal ca un catalizator nucleofil. Cu toate acestea, trei subunități diferite în fiecare dintre cele două inele sunt diferite preferințe în clivajul legăturilor peptidice imediat după resturile bazice, hidrofobe și acide.
20S subunitate hidrolizează substratul de intrare în fragmente de peptide care constau din 3-30 resturi de aminoacizi. Aceste produse peptide sunt eliberate din proteazom într-o celulă și apoi sunt supuse hidrolizei altor proteaze și aminopeptidaze.
regulament proteoliză în proteazomului are loc la trei niveluri. În primul rând, recunoașterea substratului este funcții reglabile care set pentru poliubikvitinirovaniya proteină țintă. Pentru cele mai multe proteine sunt substraturi neidentificate și includ fosforilarea, hidroxilarea rest de prolină sau identificarea clivaj semnal conținută în secvența primară. În al doilea rând, degradarea reglementată de clase specifice de substraturi pot fi realizate prin combinarea complexelor E2 / EZ cu diverși factori subsidiare.
De exemplu, în unele cazuri, și anume EZ Acesta trebuie să fie schimbat sau „pornit“, prin modificarea post-translațională pentru a lua forma sa activă, care recunoaște un substrat. În alte cazuri, stabilitatea substratului proteic depinde de asocierea sa cu chaperones moleculare, care acționează ca elemente de detecție și care servesc drept conexiuni cu ligases corespunzătoare. In particular, insulina reduce activitatea ubiquitin proteazomală mediată de proteazele intracelulare și enzimă mișcarea insulinosnizhayuschego a proteazomului 20S și 26S. În final, calea ubiquitin-proteazom poate fi controlată fie prin interacțiune sau modificări în exprimarea subunităților de proteazom ubiquitină.
Un exemplu poate fi observat după perfuzie intravenoasă de aminoacizi sau după introducerea lor în lumenul intestinal. A crescut de livrare de aminoacizi, dar nu glucoza reduce expresia ARNm al enzimei ubiquitin ubikvitinprisoedinyayuschego cu o greutate moleculară de 14 kDa, și C9 subunitate proteasom în mucoasa intestinală.
 A descoperit o noua boala a copilariei - otulipeniya
A descoperit o noua boala a copilariei - otulipeniya Descompunerea proteinelor. Fiziologia defalcare Regulamentul proteinelor
Descompunerea proteinelor. Fiziologia defalcare Regulamentul proteinelor Semnale de taxare-ca receptori. Rolul moleculei MyD88
Semnale de taxare-ca receptori. Rolul moleculei MyD88 Cross-prezentare. Răspunsul imun în absența infecției
Cross-prezentare. Răspunsul imun în absența infecției O cale alternativă a activării complementului. complex de atac al membranei de complement
O cale alternativă a activării complementului. complex de atac al membranei de complement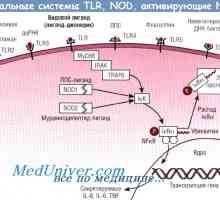 Efectul bacteriilor intestinale asupra răspunsului inflamator
Efectul bacteriilor intestinale asupra răspunsului inflamator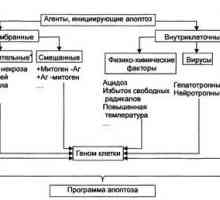 Mecanisme de apoptoză și Regulamentul
Mecanisme de apoptoză și Regulamentul Mecanisme de proteine (azot) echilibru
Mecanisme de proteine (azot) echilibru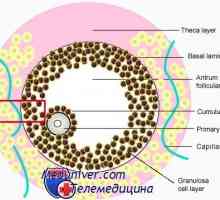 Semne de pregătire pentru meiozei ovocitului. Dizolvarea veziculă germinală (m)
Semne de pregătire pentru meiozei ovocitului. Dizolvarea veziculă germinală (m) Mecanisme degradare și catabolismul proteinelor într-un organism
Mecanisme degradare și catabolismul proteinelor într-un organism Cererea de proteine și aminoacizi într-un copil prematur
Cererea de proteine și aminoacizi într-un copil prematur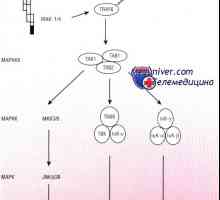 Cale Schema IRF ca răspuns la bacteriile epiteliului intestinal
Cale Schema IRF ca răspuns la bacteriile epiteliului intestinal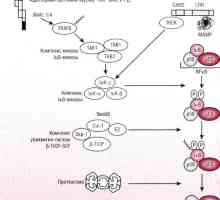 Patogeneza mod NFkB / rel în reacție la bacterii ale epiteliului intestinal
Patogeneza mod NFkB / rel în reacție la bacterii ale epiteliului intestinal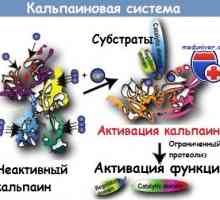 Sistemul Kalpainovaya proteoliza
Sistemul Kalpainovaya proteoliza Rolul proteinelor de semnalizare de cale morfogeneza a osului (bmp) în diferențierea celulelor stem…
Rolul proteinelor de semnalizare de cale morfogeneza a osului (bmp) în diferențierea celulelor stem… Înțeles cale Wnt semnalizare in reglarea celulelor stem intestinale
Înțeles cale Wnt semnalizare in reglarea celulelor stem intestinale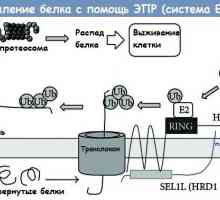 Clivajul proteinei prin reticul (ER) Sistemul erad endoplasmic
Clivajul proteinei prin reticul (ER) Sistemul erad endoplasmic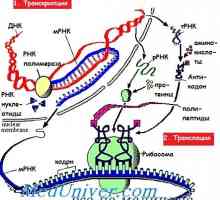 Etapele traducerii ARNm în timpul sintezei proteinelor
Etapele traducerii ARNm în timpul sintezei proteinelor A creat un leac promițător pentru cancer renal
A creat un leac promițător pentru cancer renal Broccoli antioxidant pot fi tratate progeria?
Broccoli antioxidant pot fi tratate progeria? Onkologiya-
Onkologiya-
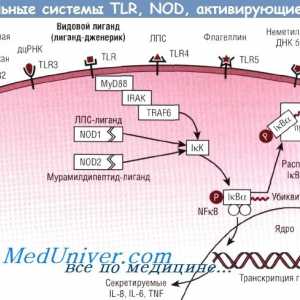 Efectul bacteriilor intestinale asupra răspunsului inflamator
Efectul bacteriilor intestinale asupra răspunsului inflamator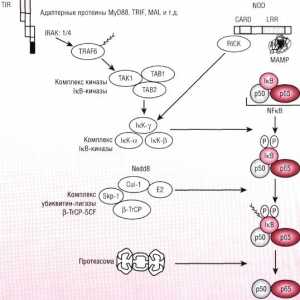 Patogeneza mod NFkB / rel în reacție la bacterii ale epiteliului intestinal
Patogeneza mod NFkB / rel în reacție la bacterii ale epiteliului intestinal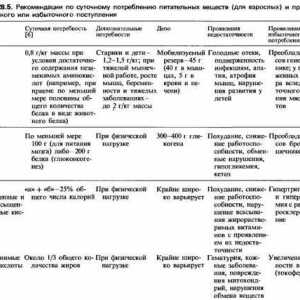 Mecanisme degradare și catabolismul proteinelor într-un organism
Mecanisme degradare și catabolismul proteinelor într-un organism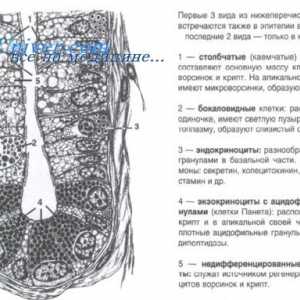 Rolul proteinelor de semnalizare de cale morfogeneza a osului (bmp) în diferențierea celulelor stem…
Rolul proteinelor de semnalizare de cale morfogeneza a osului (bmp) în diferențierea celulelor stem…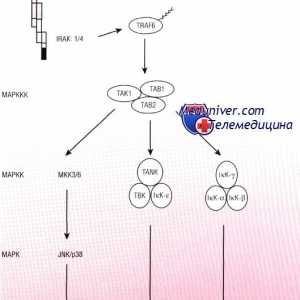 Cale Schema IRF ca răspuns la bacteriile epiteliului intestinal
Cale Schema IRF ca răspuns la bacteriile epiteliului intestinal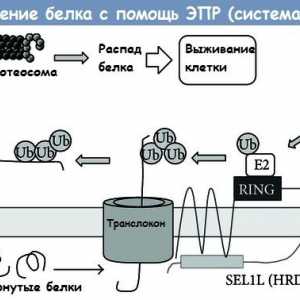 Clivajul proteinei prin reticul (ER) Sistemul erad endoplasmic
Clivajul proteinei prin reticul (ER) Sistemul erad endoplasmic